
【题目】关于以下教材中的实验说法正确的是

A. 图1中产生大量白烟,实验证明了氧气约占空气质量的1/5
B. 图2中b处气体能使燃着的木条燃烧更旺,实验说明水是由氢气和氧气组成的
C. 图3中观察到乒乓球碎片先燃着,说明燃烧的条件之一是温度要达到着火点
D. 图4观察到溶液由红色变无色,该反应实质是钠离子与氯离子结合生成氯化钠
科目:初中化学 来源: 题型:
【题目】已知 A、B、C、D、E 是初中化学常见的化合物,其中 B、C 都是氧化物, D 是一种碱,其相对分子质量为 74,A、B、D、E 属于不同类别的化合物。图中“—”表示相连的物质间能发生反应,“→”表示物质间存在转化关系。

(1)若A 属于盐,则E 属于_____,C 在生活中的一种用途是_____。
(2)若 A 属于酸,则 D 与E 反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】清华大学研究人员成功研出一种纳米纤维催化剂,可将二氧化碳催化转化成液体燃料甲醇,下图为该反应的微观模拟示意图(图中微粒恰好完全反应)。下列有关说法正确的是( )
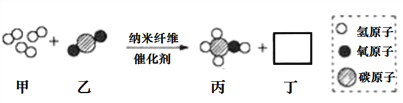
A. 该反应类型为复分解反应
B. 参加反应的甲、乙质量之比为3:1
C. 生成物丙和丁均为氧化物
D. 该反应实现了无机物到有机物的转化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图,将等质量的锌 和铁分别入入左、右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余,(U型管内为水,初始液面相平,反应过程中装置气密性良好)下列说法正确的是( )
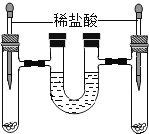
A. 右试管中溶液为黄色
B. 两试管中所得溶液的质量相等
C. U型管中液面左升右降
D. U型管中液面仍相平
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】粗盐中除了含有NaC1外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。同学们为了得到更纯的NaCl,设计了如下实验方案
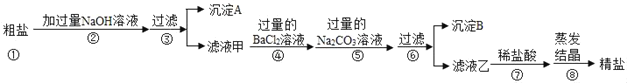
请回答下列问题
(1)请写出步骤②发生反应的化学方程式_____。
(2)若将步骤④和⑤顺序顺倒会引发的后果是_____。
(3)沉淀B中除了含有CaCO3以外还含有_____;(填化学式)
(4)滤液乙中含有的阴离子是_____。(填离子符号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国长江以南部分地区是世界三大酸雨区之一。某化学兴趣小组围绕酸雨的形成及燃煤电厂脱硫处理等问题进行探究。
I 模拟酸雨的形成
(查阅资料)
SO2转化为H2SO4的一条路径为:![]()
(操作步骤)
①组装仪器,检查装置气密性,装入药品。
②打开装置A中漏斗的活塞,启动装置B中的搅拌器,记录数据并绘图。
③待pH值稳定在3.73左右,打开装置C中漏斗的活塞。
④待pH值稳定在3.67左右,用注射器向气球a中注入H2O2溶液。
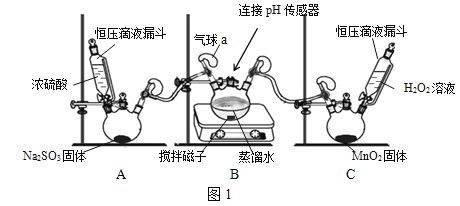
(问题讨论)
(1)装置A中发生的反应为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O,其中Na2SO3中硫元素的化合价为______。装置C中发生反应的化学方程式为______。图1装置中安装气球的主要目的是______。
(2)向H2SO3中通入O2,H2SO3被氧化成酸性更强的H2SO4,但图2中pH变化不明显,这既与O2的氧化能力有关,又与氧气______的性质有关。注入H2O2溶液后,pH值明显降低,说明H2O2的氧化性比O2______(填“强”或“弱”)。
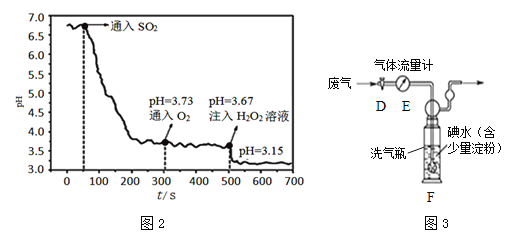
II 脱硫与SO2含量测定
(3)在燃煤中添加石灰石,SO2与石灰石、O2反应,生成硫酸钙和一种对环境无污染的气体,反应的化学方程式为______。下列措施能提高脱硫效率的是______。
A 无限延长脱硫时间 B 适当增加石灰石的用量
C 把工厂烟囱造得尽可能高 D 将石灰石和原煤粉碎并混合均匀
(4)已知燃煤电厂SO2排放标准为35mg/m3。小组同学设计图3装置进行实验:打开活塞D,将某燃煤电厂废气经气体流量计通入装置F(发生的反应为SO2+I2+2H2O===2HI+H2SO4),当碘水由蓝色褪为无色时,关闭活塞D,读出废气累计流量为3m3,若碘水中碘(I2)的质量为0.6g,计算该废气中SO2含量为______mg/m3(保留到小数点后一位),该厂废气______(填“符合”或“不符合”)排放标准。若装置F中蓝色消失后,没有及时关闭活塞D,测得的SO2含量将______(填“偏高”、“偏低”或“无影响”)。
III 知识拓展
自然界中的臭氧(O3)和H2O2能氧化H2SO3,大气污染物中含Fe、Cu、Mn、V的化合物能加快酸雨形成,一天内可在高空扩散700 多公里,所以酸雨不仅是区域性的危害,也是周边地区甚至跨国境的危害。
(5)由资料可知,大气中Fe、Cu、Mn、V的化合物可能充当了______的角色。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制。以粗盐为原料的“氯碱工业”流程如下:
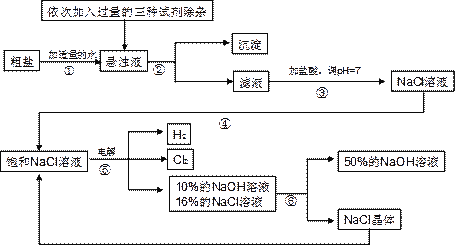
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途。下列关于氢氧化钠的描述中,错误的是 。
A.能去除油污,可做厨房清洁剂 | B.易溶于水,溶解时放出大量的热 |
C.水溶液能使石蕊溶液变红 | D.可用作某些气体的干燥剂 |
(2)操作②的名称是 ,操作④的名称是 。
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之 (填“前”或“后”)加入。有同学提出用 溶液代替BaCl2溶液可达到同样的目的。
(4)电解饱和NaCl溶液的化学方程式是 。
(5)该流程中可以循环利用的物质是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示的四个图象分别对应四种过程,其中正确的是( )
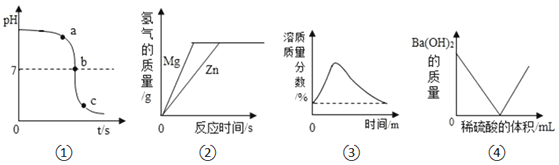
A. ![]() 将NaOH溶液逐滴滴加到盛有稀
将NaOH溶液逐滴滴加到盛有稀![]() 的烧杯中
的烧杯中
B. ![]() 分别向等质量且足量的Mg和Zn中加入等质量,等浓度的稀硫酸
分别向等质量且足量的Mg和Zn中加入等质量,等浓度的稀硫酸
C. ![]() 室温时,向一定量的饱和石灰水中加入少量氧化钙
室温时,向一定量的饱和石灰水中加入少量氧化钙
D. ![]() 向
向![]() 溶液中逐滴加入稀硫酸
溶液中逐滴加入稀硫酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】固体铵盐A、B的成分可能是(NH4)2SO4、NH4HSO4,或是两者的混合物.甲、乙两个研究性学习小组要确定A和B的成分,并测定B中氮元素的质量分数.
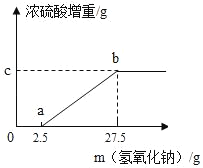
(1)甲实验小组的同学取了数份相同质量的样品A溶于水,然后加入40% NaOH溶液(图中用氢氧化钠质量表示),水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用足量浓硫酸完全吸收,浓硫酸增重的质量如图.分析该图象并回答下列问题:
①写出ab段涉及的化学方程式:_____.
②样品A的成分是_____,C点的数值是_____.
(2)乙实验小组的同学取了数份不同质量的样品B,测定方法与甲组同学大部分相同,不同的是,他们将不同质量的铵盐分别加入到50.00mL NaOH溶液中(含8.12g NaOH),测定结果如下:
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
铵盐的质量(g) | 10.00 | 20.00 | 30.00 | 50.00 |
浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
①分析实验数据可知,实验编号为_____的实验中,氢氧化钠足量,铵盐中的铵根离子完全转化成气体.
②计算B中氮元素的质量分数.______(保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com