
| V(O2)% | 实验现象 |
| 90% | 燃烧剧烈,燃烧时间长,实验成功 |
| 70% | 燃烧比90%的弱,燃烧时间短,实验成功 |
| 65% | 燃烧比70%的弱,燃烧时间比70%的短,实验成功 |
| 60% | 燃烧比65%的弱,燃烧时间更短,实验成功 |
| 55% | 难以燃烧,只是发红 |
| 实验操作 | 实验现象 |
取3根铁丝,将1根拉直,另两根绕成宽窄不同的螺旋状,进行如图所示实验. | 铁丝均燃烧,剧烈程度不同,II最剧烈,其次是 III,较弱的是 I. |
分析 (1)铁丝在氧气中燃烧生成四氧化三铁;
(2)根据铁丝可能在氧气浓度为56%~59%的范围内燃烧进行解答;
(3)探究2实验中,3根铁丝均要完全伸入集气瓶中的原因是增大反应物与氧气的接触面积;
(4)根据8根铁丝均从1根长铁丝上截取,并且长度相同进行分析;
(5)根据空气中氧气约占空气体积的五分之一,以及集气瓶的条件进行计算.
解答 解:(1)铁丝在氧气中燃烧生成四氧化三铁,反应的方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(2)铁丝可能在氧气浓度为56%~59%的范围内燃烧,所以上述关于铁丝燃烧所需氧气最低浓度的结论是不合理;
(3)探究2实验中,3根铁丝均要完全伸入集气瓶中的原因是增大反应物与氧气的接触面积;
(4)根据探究2实验,你认为乙同学说法合理,其理由是:铁丝的长度是相同的;
(5)设:收集前集气瓶中应装水体积为V
计算式为:(310mL-V)×21%+(V-30mL)=(310mL-30mL)×90%
故答案为:(1)3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(2)结论错误,应该在60%、55%再选择一些数据进行验证;
(3)增大反应物与氧气的接触面积;
(4)乙,铁丝的长度是相同的;
(5)(310mL-V)×21%+(V-30mL)=(310mL-30mL)×90%.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的提示进行解答.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
实 验 装 置 | 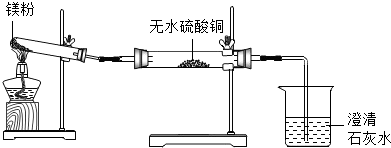 |
| 实 验 现 象 | ①无水硫酸铜粉末逐渐由白色变为蓝色 ②澄清石灰水变浑浊 |
结 论 | 久置的镁粉中除镁元素外,还含有的元素是C、H、O 久置的镁粉中含有碱式碳酸镁 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 阅读下面科普短文.
阅读下面科普短文.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 实验探究小组同学在用纯碱溶液和氢氧化钙溶液反应来制取火碱溶液时,他们发现三种溶液均呈碱性,如何确定他们恰好完全反应呢?
实验探究小组同学在用纯碱溶液和氢氧化钙溶液反应来制取火碱溶液时,他们发现三种溶液均呈碱性,如何确定他们恰好完全反应呢?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com