
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO )>c(NH
)>c(NH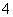 )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
科目:初中化学 来源: 题型:
下列检验和区分物质的方法正确的是
A.用酚酞试液检验 氢氧化钠溶液是否变质
氢氧化钠溶液是否变质
B.用石蕊试液检验生石灰中是否混有熟石灰
C.用水区分氯化钠和硝酸铵固体
D.用燃着的木条区分二氧化碳和氮气
查看答案和解析>>
科目:初中化学 来源: 题型:
中考化学实验考查有:①氧气的制取;②二氧化碳的制取; ③配制50g 5%的NaCl溶液;④粗盐提纯……等六个考签,由学生抽签确定一个考题进行考查。
③配制50g 5%的NaCl溶液;④粗盐提纯……等六个考签,由学生抽签确定一个考题进行考查。
 (1)甲同学抽签后来到实验室,发现本组实验桌上主要准备了下列仪器和药品:
(1)甲同学抽签后来到实验室,发现本组实验桌上主要准备了下列仪器和药品:
①上图中仪器D的名称是 ,F的名称是 。
②甲同学抽到的考签应该是 。(填标号)
A.氧气的制取和收集 B. 二氧化碳的制取和收集 D.配制50g 5%的NaCl溶液
甲同学要完成该实验考试,应该选取的仪器和药品是________ ______。(填标号)
③写出制取该气体的化学方程式 。证明该气体已经收集满瓶的方法是______________________________________________。
④甲同学实验的主要步骤示意如下,请你帮他补充完整。
组合装置→ →装入药品→收集气体。
(2)乙同学抽到完成 “粗盐提纯” 的实验考题。 下图是粗盐提纯实验过程的操作示意图。
下图是粗盐提纯实验过程的操作示意图。

请回答下列问题:
(1)写出正确的操作步骤 。(填序号)
(2)操作①中用玻璃棒搅拌的作用是  。
。
(3)操作②中的错误是 。
(4)操作⑥中,当观察到 时,停止加热。
查看答案和解析>>
科目:初中化学 来源: 题型:
类似于水的离子积,难溶盐AmBn也有离子积Ksp且Ksp=[c(An+)]m·[c(Bm-)]n,已知常温下BaSO4的溶解度为2.33×10-4 g,则其Ksp为( )
A.2.33×10-4 B.1×10-5 C.1×10-10 D.1×10-12
查看答案和解析>>
科目:初中化学 来源: 题型:
室温时,将x mL pH=a的稀NaOH溶液与y mL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
查看答案和解析>>
科目:初中化学 来源: 题型:
在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )

A.碳棒上有气体放出,溶液pH变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极流向b极
D.a极上发生了氧化反应
查看答案和解析>>
科目:初中化学 来源: 题型:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。

(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为__________________________________________;
③列式计算电极b上生成的气体在标准状况下的体积:________L;
④电极c的质量变化是__________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液________________;乙溶液________________;丙溶液________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
查看答案和解析>>
科目:初中化学 来源: 题型:
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)2NH3(g) ΔH<0
(1)当反应达到平衡时,N2和H2的浓度比是________;N2和H2的转化率比是________。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量__________,密度__________。(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将________(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com