
| 验 证 | 对比试验 | |
| 假设1 | 示例:加热烧杯,烧杯不可燃 | 点燃蜡烛,蜡烛可燃 |
| 假设2 | 常温放置蜡烛,蜡烛不燃烧 | ______ |
| 假设3 | 点燃蜡烛,蜡烛在空气中持续燃烧 | ______ |
| 物质 | 镁条 | 含碳0.05%的铁丝 | ||
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
剧烈燃烧,火星四射 |
| ||
| ||
| 验 证 | 对比试验 | |
| 假设1 | 示例:加热烧杯,烧杯不可燃 | 点燃蜡烛,蜡烛可燃 |
| 假设2 | 常温放置蜡烛,蜡烛不燃烧 | 温度要达到着火点 |
| 假设3 | 点燃蜡烛,蜡烛在空气中持续燃烧 | 与氧气(或空气)接触 |
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
剧烈燃烧,火星四射 |
| ||
| ||


科目:初中化学 来源: 题型:阅读理解
 25、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
25、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 数据记录 | 实验一 | 实验二 |
| 反应容器 | 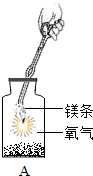 |
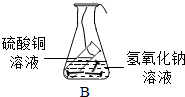 |
| 反应前(g) | 4.8 | 118.4 |
| 反应后(g) | 8.0 | 118.4 |
| 实验结论 | 在化学反应中,生成物的总质量与反应物的总质量不相等 | 在化学反应中,生成物的总质量与反应物的总质量相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
| 取袋内固体与一定量的水混合后于烧杯中,充分搅拌后过滤,向滤液中 通入二氧化碳 通入二氧化碳 . |
溶液变浑浊 溶液变浑浊 |
猜想2正确 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com