
分析 (1)根据除去水中不溶性杂质常用的操作方法分析回答;
(2)根据活性炭具有吸附性分析回答;
(3)根据区分硬水和软水的方法分析回答;
(4)根据生活中降低水的硬度的方法分析回答.
解答 解:(1)过滤能将固液分开,要除去水中不溶性杂质,要经过静置、沉淀、过等操作;
(2)活性炭具有吸附性,要吸附水中的颜色和异味,可以用活性炭;
(3)生活中可以用 肥皂水来区分硬水和软水,遇肥皂水产生泡沫少的是硬水,遇肥皂水产生泡沫多的是软水;
(4)生活中常通过煮沸 的方法降低水的硬度.
故答为:(1)过滤;(2)活性炭;(3)肥皂水;(4)煮沸.
点评 本题难度不大,掌握水的净化原理与方法、硬水和软水的检验方法等是正确解答本题的关键.


科目:初中化学 来源: 题型:实验探究题
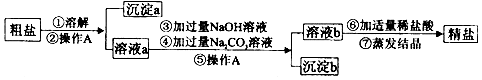
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
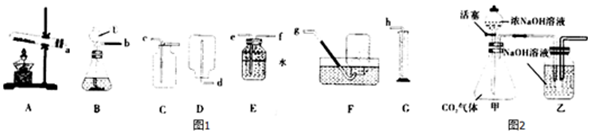
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
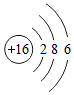 ;(4)4个氢原子4H;
;(4)4个氢原子4H;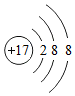 表示的是Cl-;(10)地壳中含量最多的金属元素Al.
表示的是Cl-;(10)地壳中含量最多的金属元素Al.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢气和氧气反应生成水,说明水是由氢、氧两种元素组成的 | |
| B. | 电解水生成氢气和氧气,说明水是由氢气和氧气组成的 | |
| C. | 河水经过过滤和活性炭吸附后得到的水是纯净物 | |
| D. | 水和过氧化氢的组成元素相同,所以化学性质也一样 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 为了测定某种黄铜(铜和锌的合金)的组成,现取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:(Zn+H2SO4═H2↑+ZnSO4)
为了测定某种黄铜(铜和锌的合金)的组成,现取该黄铜样品碎屑100g,把400g稀硫酸分4次加入到该样品中,测得数据记录如下表:(Zn+H2SO4═H2↑+ZnSO4)| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加人稀硫酸质量(g) | 100 | 100 | 100 | 100 |
| 剩余固体质量(g) | 87 | 74 | 67.5 | 67.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质(括号内为杂质) | 所用试剂 | 主要实验操作 | |
| A | MnO2(KCl) | H2O | 溶解、过滤 |
| B | NaCl (MgSO4) | NaOH | 溶解、过滤、蒸发 |
| C | SO2(CO) | 盐酸 | 溶解、蒸发结晶 |
| D | NH3(H2O) | 浓H2SO4 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com