
| 实验方案 | ①测溶液pH | ②滴加Na2CO3溶液 | ③滴加BaCl2溶液 |
| 实验现象 | 试纸变色,与标准比色卡比照,得pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
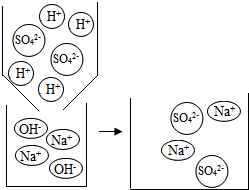

分析 【学生板演】硫酸和氢氧化钠反应生成硫酸钠和水,注意化学式的写法和配平;
【假设猜想】根据酸碱不能共存判断不合理的猜想;
【实验探究】根据碳酸钠和硫酸反应能生成二氧化碳气体解答;
【评价反思】检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀.
【剖析本质】根据酸和碱反应生成盐和水解答;
II.定量探究
根据化学方程式计算分析.
解答 解:
【学生板演】硫酸和氢氧化钠反应生成硫酸钠和水,化学方程式为H2SO4+2NaOH═Na2SO4 +2H2O;
【假设猜想】硫酸和氢氧化钠反应生成硫酸钠和水,酸或碱可能过量,但不能同时过量,因为酸碱不能共存,会继续反应,故猜想四不合理;
【实验探究】
(1)取烧杯中的少量溶液于试管中,滴加几滴酚酞溶液,无明显变化,说明溶液中一定没有氢氧化钠.
(2)溶液中有硫酸,滴加碳酸钠后,碳酸钠会和硫酸反应生成二氧化碳气体,因此会看到产生气泡.
【评价反思】检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀,故不能证明溶液中一定存在硫酸;故③错;根据酸可以和活泼金属反应产生氢气,可以选择锌粒,如果有气泡产生,说明有硫酸.
【剖析本质】补两个水分子、两个氢离子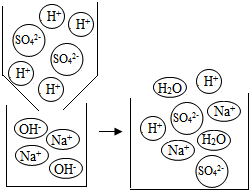
II.定量探究
解:设反应后溶液中H2SO4与NaOH反应生成的Na2SO4的质量为x
H2SO4+2NaOH=Na2SO4+2H2O
80 142
20g×10% x
$\frac{80}{20g×10%}=\frac{142}{x}$
x=3.55g
设反应后溶液中H2SO4与NaOH反应生成的Na2SO4与反应后溶液中原有Na2SO4的质量共为y
Na2SO4+BaCl2=2NaCl+BaSO4↓
142 233
y 23.3g
$\frac{142}{y}=\frac{233}{23.3g}$
y=14.2g
反应后溶液中Na2SO4的质量分数=$\frac{14.2g-3.55g}{100g}$×100%=10.65%
故答案为:
【学生板演】H2SO4+2NaOH=Na2SO4+2H2O
【假设猜想】猜想四 H2SO4和NaOH在溶液中不能共存
【实验探究】
(1)NaOH或氢氧化钠
(2)有气泡产生
【评价反思】
③Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在 锌粒
【剖析本质】
II.定量探究
反应后溶液中Na2SO4的质量分数是10.65%.
点评 此题通过中和反应考查了化学方程式的书写,实验方案设计、实验操作、实验方案的评价以及计算,解答时要全面审题,认真解答.


科目:初中化学 来源: 题型:选择题
| A. | 过滤时滤纸边缘高于漏斗口 | |
| B. | 用天平称量时,药品放在右盘 | |
| C. | 没有说明用量,取用液体药品的体积一般为1-2mL | |
| D. | 将吸取液体后的胶头滴管平放或倒置,以防液体流出 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若丙和丁分别是盐和水,则该反应一定是中和反应 | |
| B. | 若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应 | |
| C. | 若甲是有机物、乙是氧气、则该反应一定放热 | |
| D. | 若丙是铜,丁是二氧化碳、则该反应一定是置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
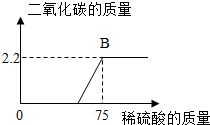 某化工厂排放的废水中含有碳酸钾和氢氧化钾,化学兴趣小组为探究废水中碳酸钾的含量,提取50g废水样品于集气瓶中,逐滴加入9.8%的稀硫酸,反应过程中产生二氧化碳的质量与加入稀硫酸的质量如下图,请计算:
某化工厂排放的废水中含有碳酸钾和氢氧化钾,化学兴趣小组为探究废水中碳酸钾的含量,提取50g废水样品于集气瓶中,逐滴加入9.8%的稀硫酸,反应过程中产生二氧化碳的质量与加入稀硫酸的质量如下图,请计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 增大可燃物热值 | B. | 增大可燃物与空气接触面积 | ||
| C. | 降低可燃物的着火点 | D. | 增大空气中氧气的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com