
分析 根据二氧化氯是由氯元素和氧元素组成的,在化合物中正负化合价代数和为零,稀硫酸、二氧化硫与氯酸钠反应生成二氧化氯和硫酸氢钠,据此进行分析解答.
解答 解:二氧化氯是由氯元素和氧元素组成的化合物,属于氧化物;氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)×2=0,则x=+4价.
稀硫酸、二氧化硫与氯酸钠反应生成二氧化氯和硫酸氢钠,该反应的化学方程式为:H2SO4+SO2+2NaClO3═2ClO2+2NaHSO4.
故答案为:氧化;+4;H2SO4+SO2+2NaClO3═2ClO2+2NaHSO4.
点评 本题难度不大,掌握酸碱盐与氧化物的判别方法、化合价的原则、化学方程式的书写方法是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25 | 28.5 | 33.3 | 40 | 55 | 75.4 |


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
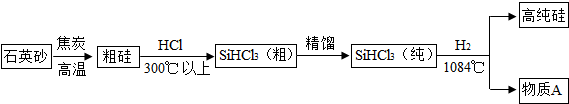
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
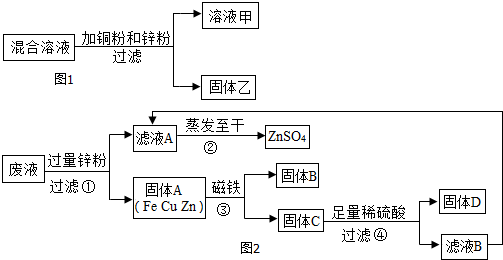
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气是人类的生命支柱,也是重要的自然资源 | |
| B. | 液氧用作宇宙火箭的燃料 | |
| C. | 空气是由多种气体组成,按质量分数算,大致是氮气占78%,氧气占21% | |
| D. | 植物光合作用产生的气体是空气的污染物之一 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
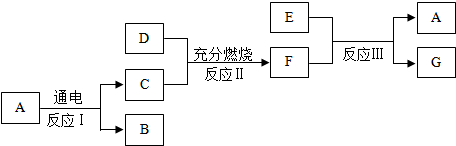
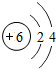 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com