
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:为了除去硝酸钾粉末中含有少量杂质氯化钾,进行下列操作:①取样,将硝酸钾溶于水;②往溶液中逐滴滴入适量的硝酸银溶液,氯化钾与硝酸银溶液反应生成氯化银沉淀和硝酸钾,至不再产生沉淀为止;③过滤;④将溶液进行蒸发,即可得到纯净的硝酸钾晶体.
故答案为:AgNO3;进行蒸发.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
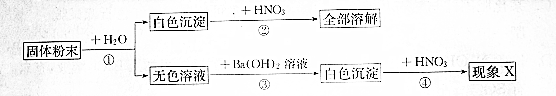
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁溶于稀硫酸,浓硫酸使有机物炭化 | |
| B. | 粉碎矿石,火药爆炸 | |
| C. | 生石灰溶于水成石灰乳,冰融化成水 | |
| D. | 汽油挥发,铁生锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验步骤 | 实验现象 | 结论 |
| 把铁片打磨后,放入硫酸铜中,观察 | 铁片表面有红色固体析出,溶液由蓝色变为浅绿色 | 金属活动性由强到弱依次为: 铁>铜>银 |
| 把铜片打磨后,放入硝酸银溶液中,观察 | 铜片表面有银白色固体析出,溶液由无色变为蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com