
分析 (1)从洗涤剂能使植物油在水中分散成无数细小的液滴去分析解答;
(2)从生石灰能和水反应生成氢氧化钙去分析解答;
(3)根据方程式的写法考虑;
(4)根据反应物、生成物以及反应的条件就可以正确写出有关反应的化学方程式;
(5)根据所给的反应规律可知醋酸与碳酸镁反应的生成物是醋酸镁和水,写出反应的化学方程式即可;
(6)由生铁的质量和杂质的质量分数可以计算出铁的质量;由铁的质量根据一氧化碳与四氧化三铁反应的化学方程式可以计算出四氧化三铁的质量;由四氧化三铁和磁铁矿中四氧化三铁的质量分数可以计算出磁铁矿的质量.
解答 解:(1)洗涤剂能使植物油在水中分散成无数细小的液滴,而不聚成大的油珠,这种现象叫乳化,乳化后的细小液滴能随着水流动,所以洗涤剂能清洗餐具上的油污;故答案为:乳化;
(2)生石灰能和水反应生成氢氧化钙,其反应的化学方程式为:CaO+H2O═Ca(OH)2;故答案为:CaO+H2O═Ca(OH)2;
(3)氢氧化镁和盐酸反应生成氯化镁和水,其反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O.故填:Mg(OH)2+2HCl═MgCl2+2H2O.
(4)根据题干提供的信息可以知道,碳酸锌首先高温分解生成氧化锌和二氧化碳,碳还原氧化锌生成锌和二氧化碳,碳还原氧化亚铜生成铜和二氧化碳,根据化学方程式的书写方法,故答案为:ZnCO3$\frac{\underline{\;800℃\;}}{\;}$ZnO+CO2↑,2ZnO+C$\frac{\underline{\;800℃\;}}{\;}$2Zn+CO2↑,2Cu2O+C$\frac{\underline{\;800℃\;}}{\;}$4Cu+CO2↑.
(5)根据所给的反应规律可知醋酸与氢氧化镁反应的生成物是醋酸镁和水,反应的化学方程式为:2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O,故答案为:2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O.
(5)解:生铁中铁的质量为2000t×(1-3%)=1940t
设需四氧化三铁的质量为x.
4CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2
232 168
x 1940t
$\frac{292}{168}=\frac{x}{1940t}$,
x≈2679.05t
需磁铁矿的质量为2679.05t÷90%≈2976.72t
故答案为:2976.72t.
点评 本题涉及知识点较多、综合性较强,化学方程式的正确书写及计算等是正确解答本题的关键,平时的学习过程中注意培养自己的知识迁移能力.生活处处有化学,学会用所学的化学知识,解决生活中的实际问题.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①④ | C. | ①②④ | D. | ②③ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
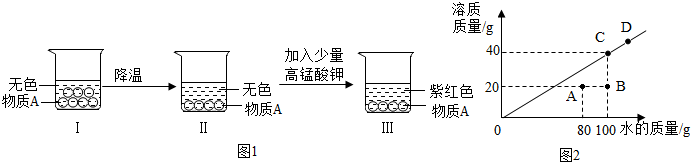
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
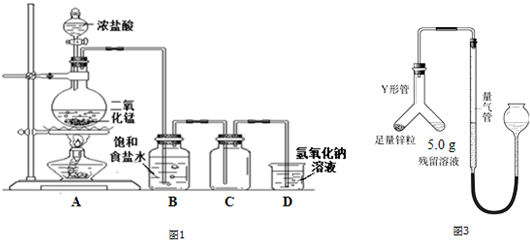
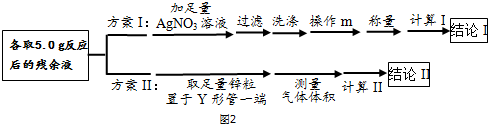
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com