
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:初中化学 来源: 题型:
 在化学学习中,我们以“透过现象看本质”的认识物质与变化.
在化学学习中,我们以“透过现象看本质”的认识物质与变化.查看答案和解析>>
科目:初中化学 来源: 题型:
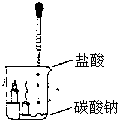 实验探究:如图所示,向烧杯内碳酸钠粉末滴入盐酸,观察到烧杯内燃着的小蜡烛下面一支火焰先熄灭,上面一支随后熄灭.这个实验可以得出的结论是:
实验探究:如图所示,向烧杯内碳酸钠粉末滴入盐酸,观察到烧杯内燃着的小蜡烛下面一支火焰先熄灭,上面一支随后熄灭.这个实验可以得出的结论是:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2011?佛山)现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠和氯化钠的质量分数,设计了如下实验方案.
(2011?佛山)现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠和氯化钠的质量分数,设计了如下实验方案.| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 盐酸的质量/g | 20 | 40 | 60 |
| 生成气体的质量/s | 2.2 | 4.4 | 5.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com