
| 混合物 | 除去杂质所用试剂 (用化学式表示) |
写出除去杂质的化学方程式 |
| 铜(氧化铜) | ||
| 氯化锌(氯化铜) | ||
| 硝酸钠(硝酸钙) | ||
| 氯化钠(硫酸铜) |
| 混合物 | 除去杂质所用试剂 (用化学式表示) |
写出除去杂质的化学方程式 |
| 铜(氧化铜) | H2SO4 | CuO+H2SO4═CuSO4+H2O |
| 氯化锌(氯化铜) | Zn | Zn+CuCl2═ZnCl2+Cu |
| 硝酸钠(硝酸钙) | Na2CO3 | Na2CO3+Ca(NO3)2═CaCO3↓+2NaNO3 |
| 氯化钠(硫酸铜) | Ba(OH)2 | Ba(OH)2+CuSO4═Cu(OH)2↓+BaSO4↓ |


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 预计现象 | 预计结论 |
| 取少量反应后的溶液于试管中, 加入 碳酸钠溶液 碳酸钠溶液 . |
先产生气体后产生沉淀 先产生气体后产生沉淀 |
猜想 C C 正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 混合物 | 除去杂质的化学方程式 | 主要操作步骤 |
| 铜粉(Fe) | Fe+2HCl═FeCl2+H2↑ Fe+2HCl═FeCl2+H2↑ |
向混合物中加入足量的稀盐酸充分反应后过滤 向混合物中加入足量的稀盐酸充分反应后过滤 |
| FeCl2溶液(CuCl2) | Fe+CuCl2═FeCl2+Cu Fe+CuCl2═FeCl2+Cu |
向混合溶液中加入足量的铁粉充分反应后过滤 向混合溶液中加入足量的铁粉充分反应后过滤 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
浓度 时间/min 催化剂 |
30%H2O2 溶液 |
15%H2O2 溶液 |
5%H2O2 溶液 |
| 加入wg MnO2 | 0.2 | 0.8 | 2.0 |
| 加入wg Fe2O3 | 7.0 | 9.0 | 16.0 |
查看答案和解析>>
科目:初中化学 来源:北京名校精典初中化学习题集 题型:022
现有锌粒和六种溶液:氯化铜、硝酸铁、硫酸钾、碳酸钠、烧碱、硝酸钡,将其两两混合做以下实验,请根据实验现象填写下列表格:
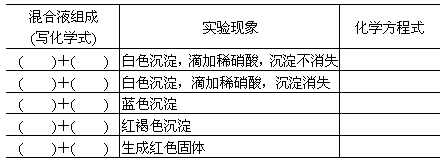
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
小丽同学在一次课外实验探究酸的化学性质时误将过氧化氢(H2O2)溶液当作酸与氧化铁(Fe2O3)粉末混合,发现有大量气泡产生。她联想到二氧化锰(MnO2)可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白。
【猜想】Fe2O3能否作为H2O2分解的催化剂。
【实验验证】小丽同学一次设计了三个实验
实验一 取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,观察到木条没有复燃,说明H2O2溶液常温下分解缓慢。
实验二 在实验一的试管中加入wg Fe2O3粉末,有大量气泡产生,然后伸入带火星的木条,观察到木条复燃,说明 。
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为wg,说明 。
【实验结论】小丽同学认为,Fe2O3粉末可以作为H2O2分解的催化剂。
【反思评价】小江同学认为要证明小丽同学的结论正确,仅做这三个实验还不充分,需要补充一个探究实验,探究Fe2O3粉末的化学性质在反应前后没变.
【拓展】下表是同学们探究影响H2O2分解因素时所记录的部分数据:
用足量等体积H2O2溶液制取相同体积O2所需时间
|
时间/min
催化剂 | 30%H2O2 溶液 | 15%H2O2 溶液 | 5%H2O2 溶液 |
| 加入wg MnO2 | 0.2 | 0.8 | 2.0 |
| 加入wg Fe2O3 | 7.0 | 9.0 | 16.0 |
通过对表格中的数据进行分析,你能得出的结论是 。
【延伸】 小明同学看到Fe2O3也能做H2O2分解的催化剂,还联想到一种蓝色的CuSO4溶液也能做H2O2分解的催化剂,请你一起参与计算:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com