
| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | FeSO4溶液 | D. | AgNO3溶液 |
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答 解:A、Zn>H>Cu,故锌能与稀硫酸反应生成氢气,而铜不与稀硫酸反应生成氢气,现象不同,可以使用稀硫酸确定锌和铜的活动性强弱;
B、锌在铜的前面,锌能与硫酸铜溶液反应生成铜,可以使用锌与硫酸铜溶液确定锌和铜的活动性强弱;
C、Zn>Fe>Cu,锌能与硫酸亚铁反应生成铁,而铜不与硫酸亚铁反应,故使用硫酸亚铁溶液可以确定锌和铜的活动性强弱;
D、锌能与硫酸银反应,铜能与硫酸银溶液发生置换反应,现象相同,不可以使用硫酸银溶液确定锌和铜的活动性强弱;
故选D.
点评 本题考查了金属活动性顺序的应用,同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:解答题
 某补钙剂说明书的部分信息如图所示,现将20片该药剂制成的粉末与40g盐酸混合(其他成分不与盐酸反应),恰好完全反应.反应后称得剩余物的质量为55.6g.
某补钙剂说明书的部分信息如图所示,现将20片该药剂制成的粉末与40g盐酸混合(其他成分不与盐酸反应),恰好完全反应.反应后称得剩余物的质量为55.6g.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
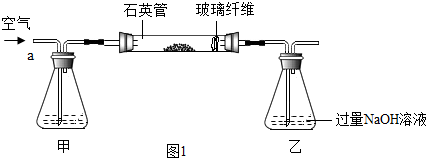
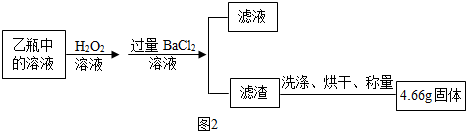
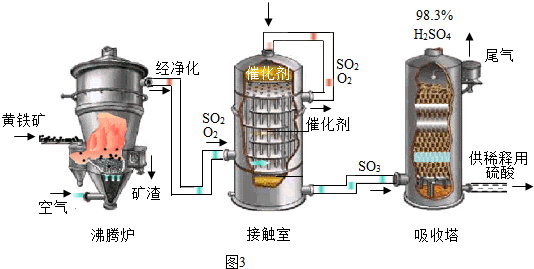
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 白磷应保存在冷水中隔绝空气--防止自燃 | |
| B. | 汽油加油站要严禁烟火--防止爆炸 | |
| C. | 家用煤气泄露时要洒大量水溶解--防止火灾 | |
| D. | 长期保存的食品真空包装隔绝空气--防止缓慢氧化 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
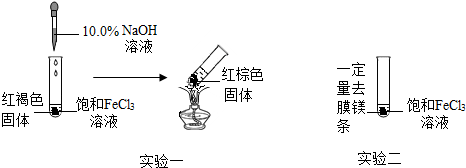
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
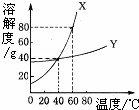 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若56 g CO参加反应,则消耗O2的质量一定是32 g | |
| B. | 若16 g O2参加反应,则生成CO2的质量一定是44 g | |
| C. | 若10 g CO2生成,则消耗CO和O2的质量总和一定是10 g | |
| D. | 若5 g CO与2 g O2混合点燃,则生成CO2的质量一定是7 g |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 在现代生活中,人们越来越注重微量元素的摄取.碘元素对人体有着至关重要的作用.如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.
在现代生活中,人们越来越注重微量元素的摄取.碘元素对人体有着至关重要的作用.如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com