
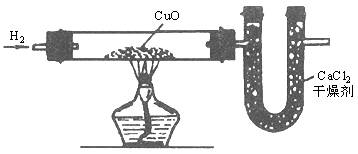
氧化铜和玻璃管在通入氢气前的总质量是56g;在通入氢气完全反应后的总质量为51.2g;氯化钙和U形管在实验前的总质量是104.6g;在实验后的总质量是110g,求
(1)完全反应后生成水的质量。
(2)生成的水中氧的质量。
(3)生成的水中氢的质量。
(4)水中氢和氧的质量比。
| 解:氯化钙和U形管实验后总质量的增加,是因为吸收了氢气还原氧化铜生成的水。所以实验前后总质量之差即是生成水的质量。氧化铜失去氧还原成铜,质量减少,所以氧化铜和玻璃管在反应前后的总质量之差,即是氧化铜失去氧的质量。是氢气夺取了氧化铜的氧,并与之化合生成水,所以生成的水中氧的质量即是氧化铜失去氧的质量。水的质量减去水中氧的质量,就是水中氢元素的质量。
(1)生成水的质量:110g-104.6g=5.4g (2)生成水中氧的质量:56g-51.2g=4.8g (3)生成的水中氢的质量:5.4g-4.8g=0.6g (4)水中氢和氧的质量比:0.6g∶4.8g=1∶8
|


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源:2011年专题训练:化学实验(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com