用氢气还原16克氧化铜,反应一段时间后,生成6.4克铜,剩余的干燥氧化铜与100克稀硫酸恰好完全反应,求
(1)有多少克氧化铜被氢气还原?
(2)将得到的硫酸铜溶液蒸发掉多少克水后,在18℃时刚好达到饱和?
(18℃时硫酸铜溶解度为20克.)
【答案】
分析:把生成的铜的质量代入有关的化学方程式进行计算就可求出被氢气还原的氧化铜的质量,然后根据未被还原的氧化铜的质量求出和稀硫酸反应生成的硫酸铜的质量,由于氧化铜与稀硫酸反应时生成的是可溶性的硫酸铜和水,因此得到的硫酸铜溶液就是参与反应的氧化铜和稀硫酸的质量之和.固体的溶解度是指在一定温度下,某固体物质在100克溶剂中达到饱和状态时所溶解的质量.
解答:解:(1)设被氢气还原的氧化铜的质量为x.
H
2+CuO
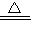
Cu+H
2O
80 64
x 6.4g

=

x=

=8g
(2)设生成的硫酸铜的质量为y,蒸发掉水的质量为z.
CuO+H
2SO
4=CuSO
4+H
2O
80 160
16g-8g y
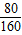
=

y=
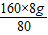
=16g

=

z=12g
答:(1)有8g氧化铜被氢气还原,(2)蒸发掉12g水后,硫酸铜溶液达到饱和.
点评:本题难度不是很大,主要考查了根据化学方程式进行相关的计算及固体溶解度概念的应用,从而培养学生对概念的理解和根据化学方程式进行计算的能力.

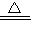 Cu+H2O
Cu+H2O =
=
 =8g
=8g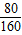 =
=
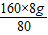 =16g
=16g =
=

