
| 同学 | 甲 | 乙 | 丙 |
| 所取海水样品质量/g | 100 | 50 | 50 |
| 加入AgNO3溶液的质量/g | 50 | 50 | 75 |
| 反应后所得沉淀的质量/g | 1.435 | 1.435. | 1.435 |
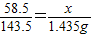
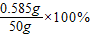 =1.17%
=1.17%

科目:初中化学 来源: 题型:
为了对海水的氯化的(假调NaCL计算)进行成分分析,甲、乙、丙三位同学分别进行实验,他们的实验数据如下,请仔细观察分析,回答下列问题:
| 甲 | 乙 | 丙 | |
| 所取海水样品的质量(g) | 100 | 50 | 50 |
| 加入AgNO3溶液的质量(g) | 50 | 50 | 75 |
| 反应后所得的沉淀的的质量(g) | 1.435 | 1.435 | 1.435 |
(1)两溶液恰好反应的是 的实验。
(2)请计算海水中的氯化的(以氯化钠计算)的质量分数是多不?(最后的结果保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com