
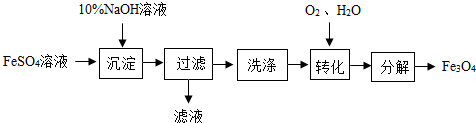
| A. | 理论上与FeSO4反应的NaOH溶液的质量为4.8t | |
| B. | 理论上“转化”过程参与反应的O2的质量为320kg | |
| C. | 该方法理论上最终可以获得Fe3O4的质量为4.64t | |
| D. | 若“转化”过程参与反应的O2过量,则最终所得固体的质量偏小 |
分析 硫酸亚铁溶液中加入氢氧化钠溶液,亚铁离子先与氢氧根离子反应生成白色的氢氧化亚铁,氢氧化亚铁很快被氧化,变成灰绿色,最终氢氧化亚铁会被氧化成红褐色的氢氧化铁沉淀,据此写出反应的化学方程式.
解答 解:在FeSO4溶液中加入NaOH溶液,先生成白色絮状沉淀,反应化学方程式为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,氢氧化亚铁不稳定,很快被氧化成 灰绿色,最终被氧化成红褐色的氢氧化铁沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
A、设理论上与FeSO4反应的NaOH的质量为x
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,
152 80
9.12t x
$\frac{152}{80}$=$\frac{9.12t}{x}$
x=4.8t
NaOH溶液的质量为$\frac{4.8t}{10%}$=48t
故错误;
B、理论上“转化”过程参与反应的O2的质量为y,则
4FeSO4 ~4Fe(OH)2~O2
608 32
9.12t y
$\frac{608}{32}$=$\frac{9.12t}{y}$
y=0.48t=480kg
为了得到Fe3O4(可以看成是FeO和Fe2O3的等分子混合的混合物),所以FeSO4中转化为氢氧化亚铁和氢氧化铁的FeSO4比为1:2,也就是FeSO4中的铁只能有三分之二转化为4Fe(OH)3,所以O2的理论用量为480kg的三分之二,即320kg.
故正确;
C、该方法理论上最终可以获得Fe3O4的质量为z
9.12t×$\frac{56}{152}×$100%÷$\frac{56×3}{232}$=4.64t
故正确;
D、9.12tFeSO49.12t,中铁元素的质量=3.36t,Fe3O4的质量为3.36t÷$\frac{56×3}{232}$=4.64t,若“转化”过程参与反应的O2过量,则最终所得固体为Fe2O3,质量为3.36t$÷\frac{56×2}{160}$=4.8t,质量偏大,故错误.
答案:BC
点评 本题考查了亚铁离子与氢氧根离子的反应原理及现象,题目难度不大,注意掌握亚铁离子、铁离子的性质及检验方法,明确亚铁离子与氢氧根离子的反应现象是解答本题关键,要求学生能够正确书写反应的化学方程式.本题考查了亚铁离子与氢氧根离子的反应原理及现象,题目难度不大,注意掌握亚铁离子、铁离子的性质及检验方法,明确亚铁离子与氢氧根离子的反应现象是解答本题关键,要求学生能够正确书写反应的化学方程式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:初中化学 来源: 题型:选择题
| A. | NaCl 氯化钠 食盐 | B. | CaO 氧化钙 熟石灰 | ||
| C. | Na2CO3 碳酸钠 纯碱 | D. | NaOH 氢氧化钠 烧碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 腌制的泡菜虽然富含亚硝酸盐,但多吃无妨 | |
| B. | 焊接金属时用氧气做保护气 | |
| C. | 铵态氮肥与熟石灰混合使用可以明显提高肥效 | |
| D. | 回收各种废弃塑料,能有效解决“白色污染”问题 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应物锂是金属单质 | B. | 该反应中MnO2是催化剂 | ||
| C. | Li2O2中氧元素的化合价显-2价 | D. | 该反应是化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | N2O | B. | NO2 | C. | N2O5 | D. | NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com