
分析 根据在水溶液中电离出的阳离子全部是氢离子的化合物叫酸,在水溶液中电离出的阴离子全部是氢氧根离子的化合物叫碱,盐在水溶液中会电离出金属离子和酸根离子的化合物;硫酸根离子和钡离子反应会生成白色的硫酸钡沉淀进行分析.
解答 解:在水溶液中电离出的阳离子全部是氢离子的化合物叫酸,在水溶液中电离出的阴离子全部是氢氧根离子的化合物叫碱,盐在水溶液中会电离出金属离子和酸根离子的化合物,所以碱式硫酸铜,化学式为Cu4(OH)6SO4,属于盐;
根据查阅的资料可以知道碱式硫酸铜为溶解度极小的物质,所以可以用蒸馏水来多次洗涤绿色沉淀至洗涤液中用BaCl2溶液检验不出SO42-后,用稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶解液中有大量白色BaSO4生成,表示浅绿色沉淀中有SO42-.
故答案为:盐;将浅绿色的浊液过滤,并把得到的绿色沉淀用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO42-后,用稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶解液中有大量白色BaSO4生成,表示浅绿色沉淀中有SO42-.
点评 本题主要考查了鉴别硫酸根离子的方法,要排除溶液中碳酸根离子的干扰.


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:初中化学 来源: 题型:解答题
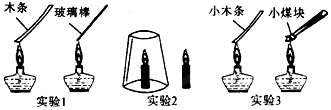
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
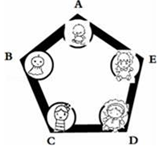 兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)
兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)查看答案和解析>>
科目:初中化学 来源: 题型:填空题
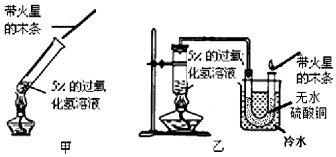
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳粉 | B. | 碱石灰 | C. | 铁粉 | D. | 二氧化锰 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 离子也是构成物质的基本粒子 | B. | 燃烧并不一定要有氧气 | ||
| C. | 反应产物中有氯离子 | D. | 金属和非金属反应一定生成盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
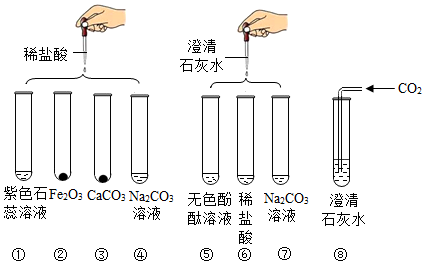
| 步骤 | 操作 | 现象 | 结论 |
| 第一步 | 取样,加入少量盐酸 | 无气泡产生 | 废液中一定没有碳酸钠 |
| 第二步 | 再次取样,进行实验⑧ | 无白色沉淀产生 | 废液中只有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 药品取用:将试管竖直,垂直放入锌粒 | |
| B. | 区别物质:用pH试纸可以区别两种不同浓度的NaCl溶液 | |
| C. | 气体净化:除去CO2中混有的少量CO,可通入O2点燃 | |
| D. | 气体收集:CO2和O2密度比空气大,故都能用向上排空气法收集 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
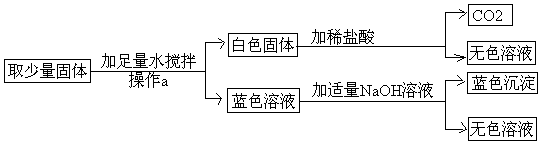
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com