
【题目】某小组为探究碳酸钠的化学性质,如图所示,将四种物质分别加入到盛有碳酸钠溶液的试管中。请根据实验探究下列问题:
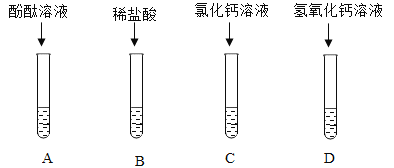
(1) A试管中溶液变红,说明碳酸钠溶液显___________(选填“酸性”、“碱性”或“中性”)。
(2) 写出B试管中发生反应的化学方程式______________。
(3)写出D试管中发生反应的化学方程式______________。
(4)实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,最终观察到烧杯底部有沉淀,上层为红色溶液。
[结论]上层溶液中一定不含①_____________(填离子符号), 理由是②______________。
[再探究]为探究上层溶液中含有哪些阴离子,帮助小组同学完成如下实验:
实验步骤 | 实验现象 | 实验结论 |
取溶液少许于试管中,加入足量的钙盐是_③_________ | 生成白色沉淀, 且溶液呈无色 | 则废液中一定含有的阴离子 是___________④(写离子符号) |
【答案】碱性 ![]()
![]() H+ 上层溶液显碱性,氢离子与氢氧根离子和碳酸钙沉淀不能共存 CaCl2溶液(或Ca( NO3)2) CO32-、Cl-
H+ 上层溶液显碱性,氢离子与氢氧根离子和碳酸钙沉淀不能共存 CaCl2溶液(或Ca( NO3)2) CO32-、Cl-
【解析】
结论:实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,最终观察到烧杯底部有沉淀,上层为红色溶液,说明上层溶液显碱性,且沉淀为碳酸钙沉淀。
再探究:试管B和试管C中稀盐酸和氯化钙中的氯离没有参加复分解反应,故实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,溶液中一定含有氯离子。
碳酸根离子可用可溶性钙盐、钡盐或酸来检验。
(1)碱性溶液能使无色的酚酞试液变红色,A试管中溶液变红,说明碳酸钠溶液显碱性;故填:碱性;
(2)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳;故填:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠;故填:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)①实验结束后将A、B、C、D四只试管中的废液倒入同一只洁净的烧杯中,最终观察到烧杯底部有沉淀,上层为红色溶液,说明上层溶液显碱性,即含有氢氧根离子,而氢离子与氢氧根离子和碳酸钙沉淀不能共存,所以一定不含氢离子;故填:H+;上层溶液显碱性,氢离子与氢氧根离子和碳酸钙沉淀不能共存;
③废液中一定含有氯离子,实验中加入钙盐检验的是碳酸根离子,此钙盐可以是氯化钙溶液或硝酸钙溶液,钙离子与碳酸根离子结合成碳酸钙白色沉淀,溶液无色说明没有氢氧根离子,故填:CaCl2溶液(或Ca( NO3)2溶液);CO32-、Cl-。


 精英口算卡系列答案
精英口算卡系列答案科目:初中化学 来源: 题型:
【题目】电影《复仇者联盟》中,美国队长和蜘蛛侠使用的武器和衣服如图所示,请回答下列问题:

(1)图中标示的物质中,属于金属材料的是______________,属于有机合成材料的是___________。
(2)艾德曼合金钢属于____________(填纯净物或混合物),其含有主要元素是_____________(填元素符号),它与生铁的区别是________。
(3)科技的进步促进材料的发展,请你谈一谈化学材料与生活的关系_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某品牌粉笔的成分为碳酸钙、硫酸钙,可能含有少量氧化钙。取37g干燥的粉笔研磨成粉末,加入足量稀盐酸,充分反应后得到8.8g气体。将反应后的固液混合物蒸干,测得其中钙元素质量为13.5g。(说明:硫酸钙与稀盐酸不反应)
(1)根据化学方程式计算37g粉笔中碳酸钙的质量。
(2)推断该粉笔中是否含有氧化钙。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为____)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。
过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应热量__________(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁(Mg2(OH)2CO3)和30%的过氧化氢溶液来制取过氧化镁。
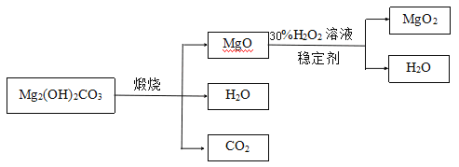
(资料)①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳②氧化镁与过氧化氢反应放出大量的热
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是________。
(4)用上述碱式碳酸镁在550、600、650及700℃下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与30%双氧水反应合成过氧化镁产率(见图1和图2)。
碱式碳酸镁煅烧的温度适宜控制在________℃,煅烧的时间适宜控制在______h。
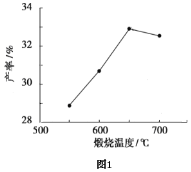
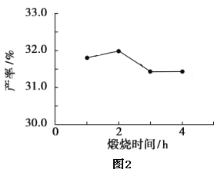
(5)结果在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因____。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。

①检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
②打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
③再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A 生成的氧气有少量溶于水 B 未等装置冷却到室温就开始读数
C 杂质与盐酸反应能产生少量的气体 D 滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为A、B、C三种固体物质(不含结晶水)在水中的溶解度曲线,请回答下列问题。
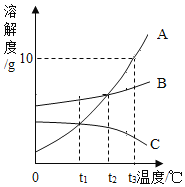
(1)气体的溶解度随温度的变化情况与___________相似(选填 “A”、“B”或“C”)。
(2) t2C时,在25g水中最多溶解1.6gA物质,则A物质在t2°C时的溶解度为_____________。
(3) t3C时,将l0gA物质加入到50g水中,充分溶解后,所得溶液中溶质和溶液的质量比为_____________。
(4)将t3C时的A、B、C三种物质的饱和溶液降温至t2C,析出晶体最多的是_________(选填“A”、“B”、“C”或“不能确定”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据图1、2所示信息,回答相关问题。
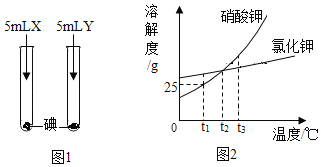
(1)图1所示实验,X、Y分别是水和汽油中的一种,实验中观察到:加入X后固体消失并得到棕色溶液,加入Y后固体未消失,则X是_______________,由实验可知,物质的溶解性与________________有关。
(2)图2为硝酸钾和氯化钾的溶解度曲线,则:
①t1°C时,硝酸钾的溶解度为_________________________。
②t1°C时,将20g硝酸钾加入到50g水中,充分溶解后,所得溶液中溶质的质量分数为__________________。
③t2°C时,氯化钾的饱和溶液中含有少量硝酸钾,提纯氯化钾的方法是_________________________。
④将t3°C时硝酸钾、氧化钾的饱和溶液各100g 分别蒸发10g水,然后降温至t2°C,过滤,得到硝酸钾溶液a和氯化钾溶液b。对于溶液a和溶液b,下列说法正确的是__________________________。
A 都是饱和溶液
B 溶质质量a=b
C 溶质的质量分数a=b
D 溶液质量a<b
E 溶剂质量a<b
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“碳足迹”(见图)标示着一个人或者团体的碳耗用量,一般悄况下,人们消耗的能源越多,排放的二氧化碳越多,碳足迹就越大。碳足迹的计算包括一切用于电力、建设、运输等方面的能源以及我们所使用的消耗品。下列做法不能有效减小“碳足迹”的是( )

A.减少一次性产品的使用
B.绿色出行,多采用自行车和步行方式
C.大量使用煤、石油等化石燃料
D.将生活垃圾进行分类回收处理
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO2(如图).则关于该方法的叙述不正确的是( )
A. 该方法中包含三种基本化学反应类型
B. 物质①是NaOH溶液
C. 操作①是蒸发浓缩、降温结晶
D. 该方法需要消耗一定的能源
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用所学知识回答下列问题:
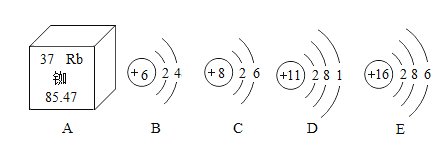
(1)我国的北斗导航卫星系统采用铷原子钟,提供精确时间。从图A可知,铷原子的质子数为_____,其中子数和质子数之差约为_____。
(2)B~E是四种粒子的结构示意图,D在化学反应中易_____电子(填“得”或“失”);其中与E化学性质相似的粒子是_____(填字母)。
(3)元素D和E形成的化合物的化学式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com