
 某校化学研究性学习小组共同探究制取气体的原理、方法的有关实验.某同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.
某校化学研究性学习小组共同探究制取气体的原理、方法的有关实验.某同学将所学气体制取的知识整理如下,请你帮助他完成相关内容.
| ||
| ||
| ||


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:初中化学 来源: 题型:阅读理解
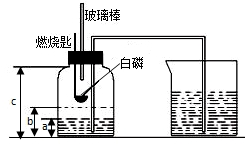 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
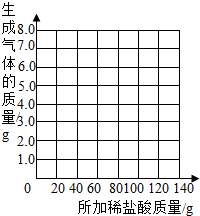
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 猜想 | 简单实验方案 | 现 象 | CO和CuO反应的化学方程式 | ||||||||
Cu2O Cu2O |
取少量红色粉末放于试管中,向其中加入足量稀硫酸,振荡 取少量红色粉末放于试管中,向其中加入足量稀硫酸,振荡 |
溶液变为蓝色,仍有红色固体 溶液变为蓝色,仍有红色固体 |
2CuO+CO
2CuO+CO
|
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
| 除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钙溶液,充分反应后过滤 | 产生白色沉淀 产生白色沉淀 |
有关反应的化学方程式为 Na2CO3+CaCl2=2NaCl+CaCO3↓ Na2CO3+CaCl2=2NaCl+CaCO3↓ |
| 检验是否含有氢氧化钠 | 向过滤后的滤液中滴入 酚酞试液 酚酞试液 |
变红 变红 |
该样品中含有氢氧化钠 |
| 加入盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | 第六次 | 第七次 |
| 锥形瓶及所盛物质的总质量 | 95.00 | 120 | 145 | 170 | 192.8 | 215.6 | 240.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com