
| A. | 饱和石灰水中加生石灰,恢复到原温度,饱和溶液溶质质量分数不变,有生石灰析出 | |
| B. | 除消石灰外,其他物质溶解度均随温度升高而增大 | |
| C. | KNO3中混有NaCl杂质,可用蒸发结晶的方法提纯 | |
| D. | 某物质常温时溶解度为5g,100℃时,将10g该物质溶于90g水中,该溶液溶质质量分数可能等于10%,也可能小于$\frac{1}{21}$ |
分析 A、根据氧化钙和水反应生成氢氧化钙,放出热量,氢氧化钙的溶解度随温度的升高而减小进行分析;
B、根据气体物质的溶解度随温度的升高而减小进行分析;
C、根据硝酸钾的溶解度受温度变化影响较大进行分析;
D、根据该物质完全溶解的过程,可知溶质的质量可能等于10g(溶质与放入的物质相同),也可能大于10g(溶质与水发生化合反应),也有可能小于10g(溶质中含结晶水)进行分析.
解答 解:A、氧化钙和水反应生成氢氧化钙,放出热量,氢氧化钙的溶解度随温度的升高而减小,所以饱和石灰水中加生石灰,恢复到原温度,饱和溶液溶质质量分数不变,有熟石灰析出,故A错误;
B、气体物质的溶解度随温度的升高而减小,故B错误;
C、硝酸钾的溶解度受温度变化影响较大,所以KNO3中混有NaCl杂质,可用降温结晶的方法提纯,故C错误;
D、该物质完全溶解的过程,可知溶质的质量可能等于10g(溶质与放入的物质相同),也可能大于10g(溶质与水发生化合反应),也有可能小于10g(溶质中含结晶水),所以某物质常温时溶解度为5g,100℃时,将10g该物质溶于90g水中,该溶液溶质质量分数可能等于10%,也可能小于$\frac{1}{21}$,故D正确.
故选:D.
点评 本题主要考查了固体物质、气体物质的影响因素,难度不大,需要在平时的学习中加强记忆即可完成.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 实验序号 | 加入锌的质量/g | 稀硫酸的体积/mL | 生成硫酸锌的质量/g |
| 1 | 1.5 | 40.O | 3.22 |
| 2 | 3.0 | 40.O | m |
| 3 | 4.5 | 40.O | 9.66 |
| 4 | 6.0 | 40.O | 10.80 |
| 5 | 7.5 | 40.O | n |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
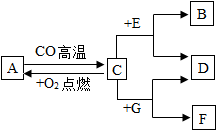 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图关系:
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图关系:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在空气中加热 | B. | 测定密度 | C. | 与氢气反应 | D. | 用磁铁吸引 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com