
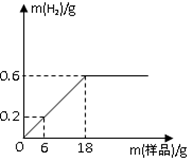
 B为测定某钢材中碳的含量(假设该钢材样品中的杂质只有碳,不溶于水也不与盐酸反应),往盛有盐酸的烧杯中不断加入钢材佯品,测得生成氢气质量与所加钢材样品质量的关系如图所示
B为测定某钢材中碳的含量(假设该钢材样品中的杂质只有碳,不溶于水也不与盐酸反应),往盛有盐酸的烧杯中不断加入钢材佯品,测得生成氢气质量与所加钢材样品质量的关系如图所示分析 由生成氢气质量与所加钢材样品质量的关系图,当两种物质恰好完全反应时,消耗的钢材样品的质量为18g,生成氢气的质量为0.6g,由反应的化学方程式,列式计算出参加反应的铁的质量,进而计算出碳的质量分数.
解答 解:(1)由图象可知,当两种物质恰好完全反应时,生成氢气的质量为0.6g.
(2)设参加反应的铁的质量为x
Fe+2HCl═FeCl2+H2↑
56 2
x 0.6g
$\frac{56}{2}=\frac{x}{0.6g}$ x=16.8g
当两种物质恰好完全反应时,消耗的钢材样品的质量为18g,该钢材样品中碳的质量分数为$\frac{18g-16.8g}{18g}×$100%≈6.7%.
6.7%>2%,故该钢材样品不合格.
答:(1)0.6;(2)该钢材样品不合格.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,细致地分析图表信息,确定生成氢气的质量是正确解答本题的前提和关键.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 大于22 mL | B. | 等于22 mL | C. | 小于22 mL | D. | 等于23 mL |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com