
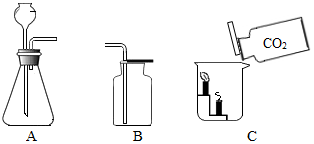
 在实验室利用以下装置进行气体的制取和性质实验.
在实验室利用以下装置进行气体的制取和性质实验.分析 (1)用装置A制取氧气,属于固液常温型,采用的分解过氧化氢溶液的方法,进行分析解答.
(2)用装置A制取二氧化碳,采用的是大理石或石灰石和稀盐酸反应的方法,进行分析解答.
(3)根据二氧化碳的化学性质、物理性质,进行分析解答.
解答 解:(1)用装置A制取氧气,属于固液常温型,采用的分解过氧化氢溶液的方法,过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)用装置A制取二氧化碳,采用的是大理石或石灰石和稀盐酸反应的方法,同时生成氯化钙、水,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(3)向烧杯内倾倒二氧化碳,会观察到下层的蜡烛先熄灭,上层的蜡烛后熄灭,是因为CO2密度比空气的大、不能燃烧、不能支持燃烧.
故答案为:(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)下层的蜡烛先熄灭,上层的蜡烛后熄灭.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取气体的反应原理、发生装置和收集装置的选择依据、二氧化碳的化学性质等是正确解答本题的关键.


科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
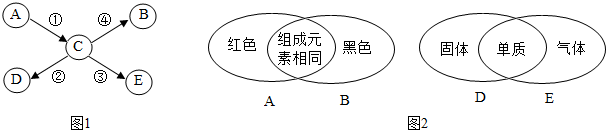
| A. | ①表示用过氧化氢溶液与二氧化锰混合物制取氧气 | |
| B. | ②表示分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量 | |
| C. | ③表示向一定量硫酸和硫酸铜混合溶液中滴入氢氧化钠溶液 | |
| D. | ④表示向一定量稀硫酸中滴入水,溶液pH与加入水的质量关系 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源:2017届广东省揭阳市揭西县九年级中考模拟化学试卷(解析版) 题型:选择填充题
在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示.下列未知数据计算正确的是( )
物 质 | a | b | c | d |
反应前的质量/g | 20 | 20 | 0 | 0 |
反应一段时间后的质量/g | 12 | 4 | 6 | ① |
反应后的质量/g | ② | 0 | ③ | ④ |
A. ①为22g B. ②为8g C. ③为12g D. ④为22.5g
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
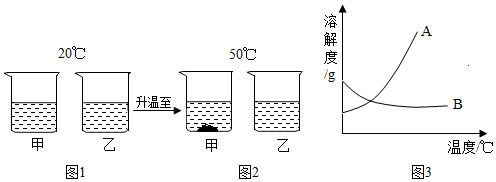
| A. | 图1中甲、乙两种溶液的溶质质量分数一定相等 | |
| B. | 图2中甲溶液一定是饱和溶液,乙溶液也可能是饱和溶液 | |
| C. | 图3中A对应的是甲物质的溶解度曲线 | |
| D. | 50℃时甲、乙两种物质的饱和溶液降温到20℃时,溶质质量分数都减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com