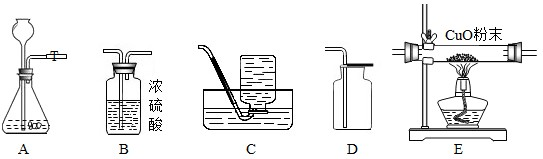
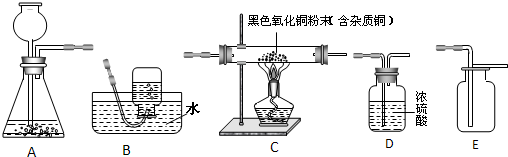
A
分析:以Zn、CuO、H
2SO
4为原料,当用两种不同的方法制备相同质量的Cu时,第一种方案:Zn+H
2SO
4=ZnSO
4+H
2↑,H
2+CuO

Cu+H
2O;第二种方案:CuO+H
2SO
4=CuSO
4+H
2O,CuSO
4+Zn=ZnSO
4+Cu.根据反应的物质之间的关系进行判断,氢气还原氧化铜,氢气必须过量,所以要使用更多锌和稀硫酸;制取相同质量的铜,铜只来源于氧化铜,所以消耗的氧化铜质量相等,据此进行分析解答.
解答:以Zn、CuO、H
2SO
4为原料,当用两种不同的方法制备相同质量的Cu时,第一种方案:Zn+H
2SO
4=ZnSO
4+H
2↑,H
2+CuO

Cu+H
2O;第二种方案:CuO+H
2SO
4=CuSO
4+H
2O,CuSO
4+Zn=ZnSO
4+Cu.
A、根据氢气还原氧化铜的实验注意事项可知,氢气要通入一段时间后才开始加热;实验完毕后,要继续通入氢气直至试管冷却;则所需H
2的质量比理论值要多一些,方案一中H
2是锌与硫酸反应生成的,故方案一消耗的锌比方案二多;故该判断不符合实际.
B、根据氢气还原氧化铜的实验注意事项可知,氢气要通入一段时间后才开始加热;实验完毕后,要继续通入氢气直至试管冷却;则所需H
2的质量比理论值要多一些,方案一中H
2是锌与硫酸反应生成的,故方案一消耗的稀硫酸比方案二多;故该判断符合实际.
C、两种制备方案中,单质Cu中的铜元素都来自于CuO,则两种方法消耗相等质量的CuO,故该判断符合实际.
D、根据氢气还原氧化铜的实验注意事项可知,氢气要通入一段时间后才开始加热;实验完毕后,要继续通入氢气直至试管冷却;则所需H
2的质量比理论值要多一些,方案一中H
2是锌与硫酸反应生成的,故方案一消耗的锌和稀硫酸比方案二多,生成的硫酸锌自然也比方案二多,故该判断符合实际.
故选A.
点评:本题难度较大,掌握两种不同的方法制备相同质量的Cu的原理、氢气还原氧化铜的实验注意事项、变化过程与相关量的关系等是正确解答本题的关键所在.

 Cu+H2O;第二种方案:CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=ZnSO4+Cu.根据反应的物质之间的关系进行判断,氢气还原氧化铜,氢气必须过量,所以要使用更多锌和稀硫酸;制取相同质量的铜,铜只来源于氧化铜,所以消耗的氧化铜质量相等,据此进行分析解答.
Cu+H2O;第二种方案:CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=ZnSO4+Cu.根据反应的物质之间的关系进行判断,氢气还原氧化铜,氢气必须过量,所以要使用更多锌和稀硫酸;制取相同质量的铜,铜只来源于氧化铜,所以消耗的氧化铜质量相等,据此进行分析解答. Cu+H2O;第二种方案:CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=ZnSO4+Cu.
Cu+H2O;第二种方案:CuO+H2SO4=CuSO4+H2O,CuSO4+Zn=ZnSO4+Cu.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案