
分析 根据铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成硫酸锌和氢气;由生成氢气的质量,根据反应的化学方程式列式计算出参加反应锌的质量、硫酸中溶质的质量以及生成的硫酸锌的质量,进而计算出所用的100g稀硫酸溶液中溶质的质量分数以及所的溶液的溶质质量分数.
解答 解:设样品中锌的质量为x,100g稀硫酸溶液中溶质的质量为y,生成硫酸锌的质量为z
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x y z 0.4g
$\frac{65}{x}=\frac{98}{y}=\frac{161}{z}=\frac{2}{0.4g}$
x=13g y=19.6g z=32.2g
所用的100g稀硫酸溶液中溶质的质量分数为:$\frac{19.6g}{100g}$×100%=19.6%.
反应后所得溶液的溶质质量分数为:$\frac{32.2g}{13g+100g-0.4g}×100%$≈28.6%
答:(1)混合物中锌的质量是13g;
(2)所用的100g稀硫酸溶液中溶质的质量分数是19.6%;
(3)反应后所得溶液的溶质质量分数为28.6%.
点评 本题难度不大,掌握化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.


科目:初中化学 来源: 题型:解答题
 人们生活中的衣、食、住、行均与化学有着密切的联系.
人们生活中的衣、食、住、行均与化学有着密切的联系.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
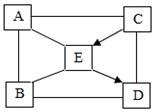 A~E是初中常见的物质:氢氧化钠、盐酸、氢氧化钙、碳酸钠、二氧化碳中的某一种.A可用于金属表面除锈,B可用来改良酸性土壤,固体C在空气中易潮解.它们相互间发生反应或转化的关系如图所示(“-”表面两种物质间能发生反应,“→”表示两种物质间的转化关系).
A~E是初中常见的物质:氢氧化钠、盐酸、氢氧化钙、碳酸钠、二氧化碳中的某一种.A可用于金属表面除锈,B可用来改良酸性土壤,固体C在空气中易潮解.它们相互间发生反应或转化的关系如图所示(“-”表面两种物质间能发生反应,“→”表示两种物质间的转化关系).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
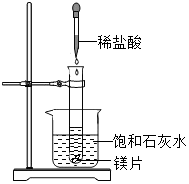 向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如右图所示.请回答:
向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如右图所示.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铝比铁活泼,所以铝制品在空气中更易腐蚀 | |
| B. | 浓盐酸具有挥发性,所以浓硫酸也具有挥发性 | |
| C. | CO和CO2的分子构成不同,所以它们的化学性质不同 | |
| D. | 溶液具有均一和稳定性,所以均一、稳定的物质一定是溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com