
| 14×2 |
| 132 |
| 该元素的相对原子质量×原子个数 |
| 该物质的相对分子质量 |
| 14×2 |
| 132 |
| 14 |
| 79 |
| 28 |
| 80 |
| 28 |
| 60 |
| 14 |
| 58.5 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:
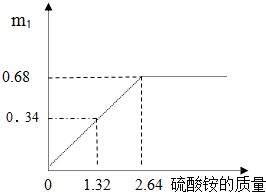 某化工集团生产的化肥硫酸铵[(NH4)2SO4],含有硫酸钾.其产品包装上标明:硫酸铵[(NH4)2SO4]≥70%.为测定该化肥产品中硫酸铵的质量分数,进行如下实验:取一定量的该化肥配成200g溶液,平均分成两份,(假设所有的反应都是完全反应)
某化工集团生产的化肥硫酸铵[(NH4)2SO4],含有硫酸钾.其产品包装上标明:硫酸铵[(NH4)2SO4]≥70%.为测定该化肥产品中硫酸铵的质量分数,进行如下实验:取一定量的该化肥配成200g溶液,平均分成两份,(假设所有的反应都是完全反应)| 加入硝酸钡溶液质量/g | 10 | 20 | 45 | 55 |
| 产生白色沉淀质量/g | 2、33 | 4、66 | 6、99 | 6、99 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、3kg | B、6kg | C、6.6kg | D、13.2kg |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
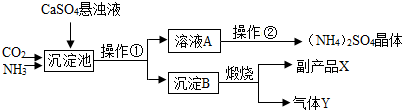
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com