
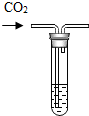
 小明同学在实验室中进行如下实验,请你和他一起完成.
小明同学在实验室中进行如下实验,请你和他一起完成.| 编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 取试管中溶液少许,滴入适量的稀盐酸 | 有气泡产生 | 猜想Ⅰ错误. |
| ② | 取试管中溶液少许,滴入稍过量的CaCl2稀溶液,过滤后,向澄清滤液中滴入无色酚酞试液 | 溶液变浑浊,有沉淀产生,溶液变成红色. | 猜想Ⅱ正确. |
| ③ | 取试管中溶液少许,滴入稍过量的CaCl2稀溶液,过滤后,向滤液中加入滴入无色酚酞试液. | 澄清滤液中加入试液后,无明显现象. | 猜想Ⅲ正确. |
分析 根据溶液配制的知识进分析,100g 10%的氢氧化钠溶液含溶质的质量是100g×10%=10g,含水的质量是100g-10g=90g,即90mL,氢氧化钠具有腐蚀性,需放在玻璃器皿中称量,配制时使用的玻璃仪器主要是烧杯、量筒、玻璃棒,使用量筒读数时仰视导致量取得水多,质量分数变小.
(2)根据氢氧化钠溶液和二氧化碳气体反应生成碳酸钠和水解答;
(3)根据要证明有氢氧化钠生成,就必须排除碳酸钠溶液的干扰.排除碳酸钠溶液的干扰时,不能加入和生成新的碱性溶液.
【反思与评价】根据滴入了稍过量的CaCl2稀溶液,其目的是可以完全除去碳酸钠解答.
解答 解:
(1)100g 20%的氢氧化钠溶液含溶质的质量是100g×20%=20g,配制时使用的玻璃仪器主要是烧杯、量筒、玻璃棒、氢氧化钠具有腐蚀性,需放在玻璃器皿中称量,使用量筒读数时仰视导致量取得水多,质量分数变小.所以本题答案为:10,90,玻璃器皿,玻璃棒,小于.
(2)氢氧化钠溶液和二氧化碳气体反应生成碳酸钠和水,反应的化学方程式为CO2+2NaOH═Na2CO3+H2O.
(3)①取试管中溶液少许,滴入适量的稀盐酸,有气泡产生,猜想Ⅰ错误.
②取试管中溶液少许,滴入稍过量的CaCl2稀溶液,过滤后,向澄清滤液中滴入无色酚酞试液,溶液变浑浊,有沉淀产生,溶液变成红色,猜想Ⅱ正确.
③取试管中溶液少许,滴入稍过量的CaCl2稀溶液,过滤后,向澄清滤液中滴入无色酚酞试液,澄清滤液中加入试液后,无明显现象. 猜想Ⅲ正确.
【反思与评价】滴入了稍过量的CaCl2稀溶液,其目的是可以完全除去碳酸钠;不能用稀盐酸替代CaCl2溶液,理由是盐酸可以和碳酸钠和氢氧化钠反应.
答案:
(1)20;量筒、烧杯、玻璃棒;玻璃器皿;使用量筒读数时仰视;
(2)CO2+2NaOH═Na2CO3+H2O;
(3)
| 编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 取试管中溶液少许,滴入适量的稀盐酸 | 有气泡产生 | 猜想Ⅰ错误. |
| ② | 取试管中溶液少许,滴入稍过量的CaCl2稀溶液,过滤后,向澄清滤液中滴入无色酚酞试液 | 溶液变浑浊,有沉淀产生,溶液变成红色. | 猜想Ⅱ正确. |
| ③ | 取试管中溶液少许,滴入稍过量的CaCl2稀溶液,过滤后,向滤液中加入 滴入无色酚酞试液. | 澄清滤液中加入试液后,无明显现象. | 猜想Ⅲ正确. |
点评 本考点属于实验设计题,是中考的重点也是一个难点,根据物质之间的反应条件,物质的溶解性规律和除杂质的条件,要认真分析,综合把握.还要加强记忆除去常用离子的方法,注意不要加入新的杂质.本题考查了溶液配制的知识,完成此题,可以依据已有的知识进行.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 54 | 17 | 20 | 10 |
| 反应后的质量/g | 10 | 0 | 2 | x |
| A. | x为89 | B. | 参加反应的丙物质的质量为20 g | ||
| C. | 该反应为分解反应 | D. | 甲物质全部反应完 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验前所取样品的质量 | 实验后得到的氯化钠溶液的质量 |
| 4.00g | 42.20g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 盗版光盘改焚烧处理为粉碎回收,二次利用 | |
| B. | 生活中一水多用,用淘米水浇花 | |
| C. | 大力发展公共交通,减少机动车尾气排放 | |
| D. | 工业污水灌入地下,减少地表水污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | FeSO4溶液(CuSO4) | 过量铁粉 | 过滤 |
| B | CO2气体(CO) | 足量氧化铁粉 | 高温加热 |
| C | CaO固体(CaCO3) | 足量的水 | 过滤 |
| D | NaCl固体(Na2CO3) | 足量稀盐酸 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 大量植树造林 | B. | 直接大量燃烧煤炭 | ||
| C. | 充分利用太阳能 | D. | 多骑自行车,少开汽车 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com