
| A. | 低血糖发作时,喝葡萄糖水比吃馒头见效快 | |
| B. | 骨质疏松的中老年人饮食中应增加含铁量丰富的食物 | |
| C. | 处于生长发育期的青少年对蛋白质的需求比成年人少 | |
| D. | 糖类、油脂和维生素都可以为人体提供能量 |
分析 A、根据葡萄糖可以直接吸收,而馒头需要经过细化后慢慢转化为葡萄糖才能被人体利用进行分析;
B、根据骨质疏松是缺乏钙元素引起进行分析;
C、根据蛋白质的生理功能分析;
D、根据娥维生素的生理功能进行分析.
解答 解:A、低血糖病症发作时,喝葡萄糖水比吃馒头见效快,因为葡萄糖可以直接吸收,而馒头需要经过细化后慢慢转化为葡萄糖才能被人体利用,故A正确.
B、骨质疏松的中老年人饮食中应增加含钙量丰富的食物,故B错误.
C、蛋白质是构成人体细胞的基本物质,人体的生长发育、细胞的更新和修复等都离不开蛋白质,因此,处于正在生长发育的青少年,应多吃含蛋白质丰富的食物,故C错误.
D、维生素既不构成细胞也不为人体生命活动提供能量,但对人体的生命活动具有重要的调节作用,故D错误.
故选A.
点评 化学来源于生产、生活,也服务于生产、生活,与人类生产、生活相关的知识历来是考查的热点,要注意平时知识的积累.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:初中化学 来源: 题型:选择题
| A. | 50% | B. | 60% | C. | 70% | D. | 80% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
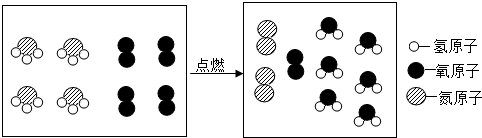
| A. | 该反应是置换反应 | |
| B. | 反应前后原子种类和数目都不变 | |
| C. | 参加反应的两种物质的分子个数比为1:1 | |
| D. | 氨气中氮元素的化合价为-3 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | |
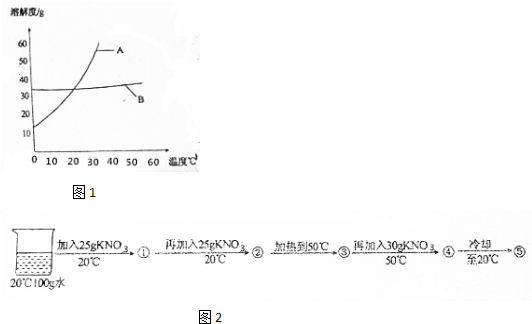
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com