
 实验室制取CO2后的废液(有HCl和CaCl2残留)200克,向废液中逐步加入(NH4)2CO3固体.充分反应后,得到溶液增加质量和加入药品质量的粗略关系如图所示.其中A点为溶液增加质量最多的时候,C点为溶液质量减少最多的时候.
实验室制取CO2后的废液(有HCl和CaCl2残留)200克,向废液中逐步加入(NH4)2CO3固体.充分反应后,得到溶液增加质量和加入药品质量的粗略关系如图所示.其中A点为溶液增加质量最多的时候,C点为溶液质量减少最多的时候.分析 (1)①根据AC段的溶液中溶质质量逐渐减小,所以是氯化钙和碳酸铵反应生成碳酸钙沉淀和氯化铵进行分析;
②根据向废液中逐步加入(NH4)2CO3固体,碳酸铵固体会先于盐酸反应,若加入的(NH4)2CO3固体中含有不参加反应且不溶于水的杂质,需要加入碳酸铵的质量质量比原来碳酸铵的质量更多时,才能出现预期的现象,所以A点在关系图中水平右移进行分析;
(2)根据向废液中逐步加入(NH4)2CO3固体,碳酸铵固体会先于盐酸反应,然后再与氯化钙反应,结合图象中的数据进行分析.
解答 解:(1)①AC段的溶液中溶质质量逐渐减小,所以是氯化钙和碳酸铵反应生成碳酸钙沉淀和氯化铵,化学方程式为:CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl;
②向废液中逐步加入(NH4)2CO3固体,碳酸铵固体会先于盐酸反应,若加入的(NH4)2CO3固体中含有不参加反应且不溶于水的杂质,需要加入碳酸铵的质量质量比原来碳酸铵的质量更多时,才能出现预期的现象,所以A点在关系图中水平右移,故选:A;
(2)①设残液中有HCl质量为x
(NH4)2CO3+2HCl=2NH4Cl+2H2O+CO2↑ 溶液质量增大
96 73 44 52
x 1.04g
$\frac{73}{x}$=$\frac{52}{1.04g}$
x=1.46g
所以原先废液轴残留的HCl的质量分数为:$\frac{1.46g}{200g}$×100%=0.73%;
②设与盐酸反应的碳酸铵固体质量为y,与氯化钙反应的碳酸铵固体质量为z
(NH4)2CO3+2HCl=2NH4Cl+2H2O+CO2↑ 溶液质量增大
96 44 52
y 1.04g
$\frac{96}{y}$=$\frac{52}{1.04g}$
x=1.92g
(NH4)2CO3+CaCl2=2NH4Cl+CaCO3↓,溶液质量减少
96 100 4
z 1.04g+0.56g
$\frac{96}{z}$=$\frac{4}{1.6g}$
x=38.4g
所以到D点时为止,加入的(NH4)2CO3固体的总质量38.4g+1.92g+0.56g=40.88g.
故答案为:(1)①CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl;
②A;
(2)①原先废液轴残留的HCl的质量分数为0.73%;
②到D点时为止,加入的(NH4)2CO3固体的总质量为40.88g.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.


科目:初中化学 来源: 题型:解答题
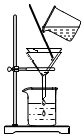 某同学用如图装置过滤浑浊的长江水,
某同学用如图装置过滤浑浊的长江水,查看答案和解析>>
科目:初中化学 来源: 题型:选择题
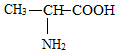 丙氨酸是组成蛋白质的成分之一,丙氨酸分子的结构式如图所示,有关丙氨酸的说法正确的是( )
丙氨酸是组成蛋白质的成分之一,丙氨酸分子的结构式如图所示,有关丙氨酸的说法正确的是( )| A. | 丙氨酸的化学式为C3H7O2 | |
| B. | 一个丙氨酸分子由11个原子构成 | |
| C. | 丙氨酸由四种元素组成 | |
| D. | 丙氨酸中碳、氢、氧元素的质量比为3:7:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 我市口子煤矿煤炭资源丰富,瓦斯存在于煤层及周围岩层中,是井下有害气体的总称,主要成分是甲烷.
我市口子煤矿煤炭资源丰富,瓦斯存在于煤层及周围岩层中,是井下有害气体的总称,主要成分是甲烷.| 可燃气体 | 爆炸极限(体积分数) |
| H2 | 4.0%~74.2% |
| CH4 | 5%~15% |
| CO | 12.5%~74.2% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 除杂试剂. |
| A | Zn(Al) | 用磁铁吸 |
| B | KOH(Ba(OH)2 | 加适量K2SO4 |
| C | HCl(H2SO4) | 加Zn |
| D | K2SO4(CuCl2) | 加适量KOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
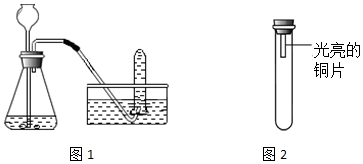
| 编号 | 主要实验操作 | 实验现象 |
| 1 | 甲中盛有过氧化氢溶液和二氧化锰,收集一试管气体 | 铜片始终无明显变化 |
| 2 | 甲中盛有大理石和稀盐酸,收集一试管气体 | 铜片始终无明显变化 |
| 3 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体 | 一段时间后铜片变绿 |
| 4 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体,并向气体中加入适量浓硫酸 | 铜片始终无明显变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 利用CO2气体就能区分NaOH、Ca(OH)2和稀盐酸三种溶液 | |
| B. | 若有BaCl2溶液,就有办法鉴别NaOH、Na2CO3、Na2SO4 | |
| C. | 有酚酞溶液,就能鉴别盐酸、Na2CO3和KNO3三种溶液 | |
| D. | 不用其它任何试剂就能将HCl、BaCl2、Na2CO3三种溶液鉴别出来 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某研究小组进行与NH3有关的系列实验.
某研究小组进行与NH3有关的系列实验.查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com