10、海水是一种化学成分复杂的混合物,包括水、溶解于水中的多种化学元素和气体.在海水中迄今已发现的化学元素达80多种.含量较高的元素除组成水的氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴、碳、锶、硼、氟等.
(1)以海水及其产品为原料可以生产许多化工产品,如氯化钠、氢气、氢氧化钠、氯气、钠、镁、食用加碘盐等.
①请根据你学过的化学知识,按照纯净物、单质、混合物、化合物,将海水、氢气、氯化钠、氯气、氢氧化钠、钠、镁、食用加碘盐进行分类.(要求用框图的形式表示,层次分明)
②在氯化钠、氢气、镁三种物质中,由分子构成的是
氢气(H2)
;由原子构成的是
镁(Mg)
;由离子构成的是
氯化钠(NaCl)
.
(2)自然界中的溴元素绝大多数存在于海洋中,其元素符号为Br,根据中文名称猜测溴应属于
非金属
(填“金属”或“非金属”)元素,该元素位于元素周期表
右侧
(填“左侧”、“右侧”或“中部”).
(3)锶是一种重要的金属元素,其原子结构示意图和在元素周期表中显示的信息见下图,请回答有关问题:
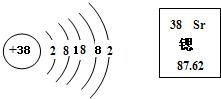
①锶原子核外的电子层数为
5
,原子核内质子数为
38
;在化学反应中易
失去
(填“得到”或“失去”)电子
②锶元素的原子序数为
38
,其相对原子质量为
87.62
;
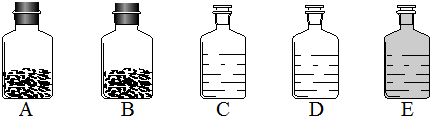
(4)海水也是未来人类生活用水的重要来源.小明同学从水产市场带回一瓶浑浊的海水,准备与同学们一起对其进行净化.请你参入他们的实验并回答有关问题.
①他们在向水中加入明矾,搅拌静置后进行过滤,加入明矾的目的是
使水中悬浮的杂质沉降
; 过滤需要的主要仪器和用品有
铁架台(带铁圈)(或漏斗架)、漏斗、玻璃棒、烧杯、滤纸
;
②下列对过滤过程及结果描述正确的是
ABC
(填编号);
A.此过程发生的是物理变化
B.过滤是利用颗粒大小不同将混合物分离
C.过滤之后得到的“水”仍是咸的
D.过滤之后得到的“水”可以饮用
③证明过滤之后得到的“水”中仍含有杂质的方法是
滴几滴水样于玻璃片上,放在酒精灯上加热,观察现象
;
④小明想把海水制成蒸馏水,他应该进行的操作是
蒸馏
,一般不用蒸馏水作为饮用水的理由是
蒸馏水中不含人体所需的多种矿物元素,长期饮用会影响健康
.
(5)海水是一种溶液,其中溶剂是水,溶质有多种,海水中溶质的质量分数约为3.5%,市场上销售的“海水精”是根据海水溶质的主要成分按比例混合而成,“海水精”是一种白色固体,易溶于水.若用“海水精”配制一定量的人造海水,请回答有关问题:
①配制步骤依次为
计算、称量(量取)、溶解
;
②所需要用到的主要仪器是
托盘天平、量筒、药匙、玻璃棒、胶头滴管、烧杯
.

 ×100%=
×100%= ×100%,配制的NaCl溶液质量分数小于10%,可能有两种情况:①溶质氯化钠质量小于实际质量②溶剂水的质量大于实际的质量.那么题目中的操作能够造成上述两种情况的就是备选的答案.
×100%,配制的NaCl溶液质量分数小于10%,可能有两种情况:①溶质氯化钠质量小于实际质量②溶剂水的质量大于实际的质量.那么题目中的操作能够造成上述两种情况的就是备选的答案.

 阅读快车系列答案
阅读快车系列答案




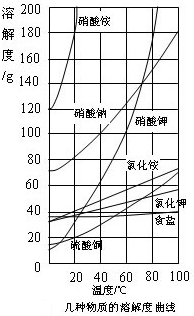 (2008?鄂州)如图是几种固体物质的溶解度曲线.请根据图完成10~12题.
(2008?鄂州)如图是几种固体物质的溶解度曲线.请根据图完成10~12题.