
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这两类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这两类化合物进行了一系列的探究活动.| 阳离子 | OH | N03- | C1- | SO42- | C03- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的氯化钡溶液 充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 Na2CO3+BaCl2=BaCO3↓+2NaCl |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 溶液变红色 | 该样品中含有氢氧化钠 |
分析 (1)浓盐酸具有挥发性,而浓硫酸没有挥发性,可以据此解答;
(2)根据稀释前后溶质硫酸质量不变计算稀释时所需要水的量;根据浓硫酸的密度和水的密度比较及浓硫酸溶解放出大量的热来分析不能将水注入浓硫酸的原因;
(3)氢氧化钠固体暴露在空气中,能吸收空气中的二氧化碳生成碳酸钠和水;利用碳酸盐的性质,检验碳酸钠的存在,证明氢氧化钠变质;选择合适的试液检验氢氧化钠是否存在;碳酸钠能与氯化钡反应形成白色沉淀,可以判断出反应产生现象,然后利用氢氧化钠能使酚酞变红的性质,再向反应后溶液中滴加酚酞试液,观察溶液颜色,以确定溶液的组成,从而判断氢氧化钠变质情况;
(4)反应后所得溶液是氯化钠溶液,根据化学方程式NaOH+HCl=NaCl+H2O和盐酸中溶质的质量可以计算出生成氯化钠的质量,最后用氯化钠的质量除以所得溶液的质量乘以百分之百便可得反应后所得溶液中溶质的质量分数.
解答 解:(1)浓盐酸具有挥发性,挥发出来的氯化氢气体能够溶于空气中的水蒸气,而形成盐酸的小液滴,形成白雾,而浓硫酸不会有明显现象,故打开瓶盖即可分开这两种物质;故填:浓盐酸具有挥发性,挥发出的氯化氢气体能够溶于空气中的水蒸气而形成白雾,浓硫酸没有明显现象产生;
(2)据标签,瓶内浓硫酸质量分数为98%,设需要水的质量为W
10g×98%=(W+10g)×20%
解之得 W=39g
故答:39;
由于浓硫酸的密度比水的大,并且浓硫酸在溶解的时候要放出大量的热,放出的热足以使水沸腾,而引起酸液的迸溅,所以为了防止酸液迸溅引起危险,而应该将浓硫酸慢慢注入水中,并不断搅拌;故填:浓硫酸的密度比水的大,并且浓硫酸在溶解的时候要放出大量的热,放出的热足以使水沸腾,而引起酸液的迸溅,所以为了防止酸液迸溅引起危险,而应该将浓硫酸慢慢注入水中,并不断搅拌;
(3)氢氧化钠固体暴露在空气中,能吸收空气中的二氧化碳生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.故填:2NaOH+CO2═Na2CO3+H2O.
①碳酸盐可以与酸反应放出能使澄清石灰水变浑浊的二氧化碳气体;所以无色溶液可能是:盐酸;故填:盐酸;
②氯化钡溶液与碳酸钠溶液反应生成碳酸钡沉淀和氯化钠,所以根据题中的实验结论可以知道能观察到的现象为:有白色沉淀生成,有关反应的化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl,而氯化钠、氯化钡溶液都呈中性;故在反应后的溶液中滴入酚酞,溶液变红色,则一定是氢氧化钠溶液使酚酞变红,所以氢氧化钠没有完全变质;故答案为:
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的 氯化钡溶液, 充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 Na2CO3+BaCl2=BaCO3↓+2NaCl |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 溶液变红色 | 该样品中含有氢氧化钠 |
点评 检验氢氧化钠与碳酸钠的混合物时,可先把碳酸钠变成沉淀并且不生成影响氢氧化钠检验的碱性物质,然后使用酚酞检验氢氧化钠.本题主要考查根据化学方程式计算和溶质质量分数的计算,难度不大.


科目:初中化学 来源: 题型:解答题
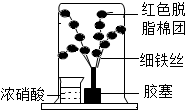 实验室新购进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究,请根据要求回答问题:
实验室新购进一批浓硝酸,化学兴趣小组为研究该试剂的保存方法,开展相关探究,请根据要求回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
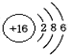 ,在化学反应中易得到电子(选填“得到”或“失去”),形成S2-(填 粒子符号).
,在化学反应中易得到电子(选填“得到”或“失去”),形成S2-(填 粒子符号).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
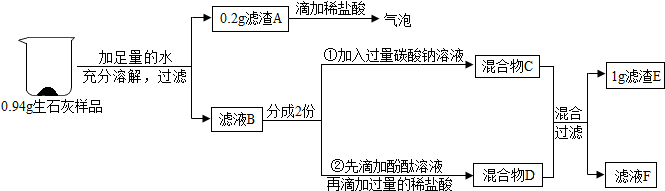
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 小倩同学的解法 | 小明同学的解法 |
| 解:设生成的铝质量为X 2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ 204108 10t X $\frac{204}{108}$=$\frac{10t}{X}$ X=5.3t 答:最多可生产5.3t铝 | 解:氧化铝中铝元素的质量分数为 $\frac{Al的相对原子质量}{A{l}_{2}{O}_{2}的相对分子质量}$×100% $\frac{27×2}{27×2+16×3}$×100%=53% 铝的质量为10t×53%=5.3t 答:最多可生产5.3t铝 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
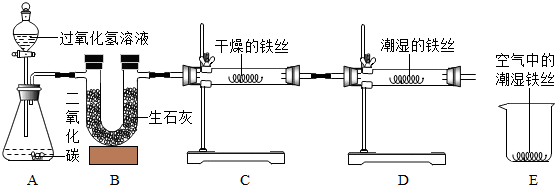
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用干冰进行人工降雨 | B. | 用二氧化碳来灭火 | ||
| C. | 进行光合作用 | D. | 制汽水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com