
科目:初中化学 来源: 题型:解答题
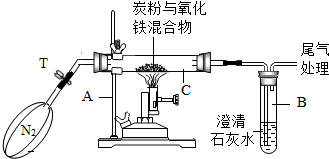 某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:
某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 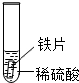 | 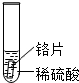 | 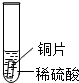 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 铜表面无气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
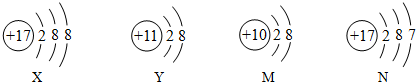
| A. | 以上四种粒子分别属于三种元素 | |
| B. | 粒子Y若得到1个电子就可以变成原子 | |
| C. | 如果X和Y能形成稳定的化合物,则化学式应为XY | |
| D. | 上述粒子中有两个是离子,两个是原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 金属及合金是重要的化工材料.
金属及合金是重要的化工材料.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
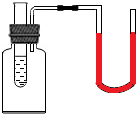 如图所示,集气瓶瓶塞中插有小试管和导管,小试管中盛有少量水,导管连接的U型管两侧内水面持平.向试管中加入下列物质中的一种,U型管两侧水面出现左低右高,则加入的物质为①CaO②NaOH③NaCl④硝酸铵⑤浓H2SO4( )
如图所示,集气瓶瓶塞中插有小试管和导管,小试管中盛有少量水,导管连接的U型管两侧内水面持平.向试管中加入下列物质中的一种,U型管两侧水面出现左低右高,则加入的物质为①CaO②NaOH③NaCl④硝酸铵⑤浓H2SO4( )| A. | ②或③或⑤ | B. | ①或③或⑤ | C. | ①或②或④ | D. | ①或②或⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 研究性学习小组进行“影响过氧化氢生成O2快慢的有关因素”的课题探究.以下是他们探究的主要过程:
研究性学习小组进行“影响过氧化氢生成O2快慢的有关因素”的课题探究.以下是他们探究的主要过程:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 制漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | |
| B. | 潜艇供氧2Na2O2+2H2O=4NaOH+O2↑ | |
| C. | 高炉炼铁3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| D. | 焊接铁轨2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al203 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com