
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:阅读理解
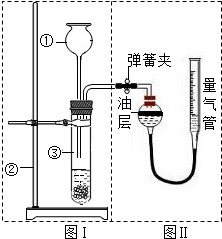 Ⅱ.小明设计了右图实验装置来证明氧化铜能加快双氧水(溶质质量分数约5%)的分解并与二氧化锰的催化效果进行比较(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
Ⅱ.小明设计了右图实验装置来证明氧化铜能加快双氧水(溶质质量分数约5%)的分解并与二氧化锰的催化效果进行比较(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:| 序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (1)按图1简易装置电解水,A、B是电源的两个电极.
(1)按图1简易装置电解水,A、B是电源的两个电极.| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
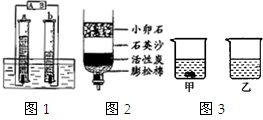
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2(2 Na2CO3?3 H2O2 )=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解;Ⅰ、制备研究:如图1是制备过碳酸钠的工艺流程.  请回答问题: (1)反应器中发生反应的化学方程式为 2Na2CO3+3H2O2═2Na2CO3?3H2O2 2Na2CO3+3H2O2═2Na2CO3?3H2O2 ;(2)生产中,反应及干燥均需在较低温度下进行,原因是 防止过碳酸钠分解,影响产量和产率 防止过碳酸钠分解,影响产量和产率 ;(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 过碳酸钠在NaCl溶液中溶解度较小,易析出晶体 过碳酸钠在NaCl溶液中溶解度较小,易析出晶体 .(4)操作A的名称是 过滤 过滤 ,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒 玻璃棒 和漏斗 漏斗 ;(5)洗涤过碳酸钠晶体最好选用 B B .A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液 (6)母液可以循环使用,其中主要含有的溶质是 NaCl NaCl 和Na2CO3(或H2O2) Na2CO3(或H2O2) ;Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数. 小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验. [实验步骤]:① 检查气密性 检查气密性 ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中不再产生气体 不再产生气体 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.[实验分析及数据处理]: (7)完善实验步骤的相关内容:① 检查气密性 检查气密性 、④不再产生气体 不再产生气体 ;(8)实验中,水的作用是 溶解过碳酸钠,利于其分解 溶解过碳酸钠,利于其分解 ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是MnO2(或CuO) MnO2(或CuO) (填化学式);(9)实验中, A A ,则开始收集气体;A.刚开始出现气泡时 B.当气泡均匀连续出现时 C.若用带火星木条放在导管口部,复燃时 (10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g?L-1.),计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr(2Na2CO3?3H2O2)=314、Mr(O2)=32] 95% 95% ;[实验反思]: (11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 ;(12)量筒中长导管的作用是 起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸) 起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸) ;(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由. 不正确,装置中原有空气和生成的O2等体积代换 不正确,装置中原有空气和生成的O2等体积代换 ;(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为 93.6% 93.6% .(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数? 想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定 想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定 .(只需给出简要的方案)
查看答案和解析>> 科目:初中化学 来源: 题型:  海洋是地球上最大的储水库,浩瀚的海洋蕴含着丰富的资源. 海洋是地球上最大的储水库,浩瀚的海洋蕴含着丰富的资源.(1)海水是溶液,其中溶剂是 水 水 .(2)海水晒盐能够得到粗盐和卤水. ①卤水中含有MgCl2、KCl和MgSO4等物质,右图是三种物质的溶解度曲线.t2℃时,三种物质的饱和溶液中,浓度最小的是 KCl KCl .②将t2℃时三种物质的饱和溶液加热到t3℃以上时,仍然为饱和溶液的是 MgSO4 MgSO4 .③将饱和氯化镁溶液由t3℃冷却至t1℃,下列四种叙述中,正确的是 BD BD (填字母).
过滤 过滤 和蒸发.在蒸发过程中,待蒸发皿中出现较多固体时,停止加热,这样操作的目的是节约能源 节约能源 .(4)将粗盐提纯可以得到纯净的NaCl.欲用9g纯净的氯化钠配制0.9%的生理盐水,可配制生理盐水 1000 1000 g.配制溶液必须用到的仪器有:托盘天平、药匙、胶头滴管、玻璃棒、量筒和烧杯 烧杯 ,其中玻璃棒的作用是加快溶解速率 加快溶解速率 .查看答案和解析>> 科目:初中化学 来源:2013年江苏省扬州市江都市网上阅卷适应性考试化学试卷(解析版) 题型:解答题 过碳酸钠广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习: [资料卡片]:
 请回答问题: (1)反应器中发生反应的化学方程式为______; (2)生产中,反应及干燥均需在较低温度下进行,原因是______; (3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______. (4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______; (5)洗涤过碳酸钠晶体最好选用______. A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液 (6)母液可以循环使用,其中主要含有的溶质是______和______; Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数. 小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验. [实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算. [实验分析及数据处理]: (7)完善实验步骤的相关内容:①______、④______; (8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式); (9)实验中,______,则开始收集气体; A.刚开始出现气泡时 B.当气泡均匀连续出现时 C.若用带火星木条放在导管口部,复燃时 (10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______; [实验反思]: (11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______; (12)量筒中长导管的作用是______; (13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______; (14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______. (15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案) 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |