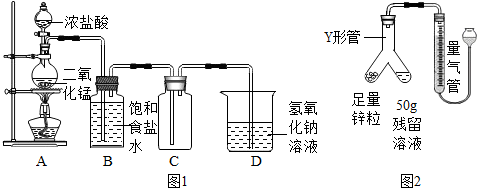
6.实验室常用二氧化锰与浓盐酸制备氯气,反应原理为:MnO
2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl
2+Cl
2↑+2H
2O.
实验装置如图1所示.
【查阅资料】
①氯气是黄绿色且有毒的气体,难溶于饱和食盐水.
②氯气能与氢氧化钠溶液反应,生成氯化钠、次氯酸钠(NaClO)和水.
③常温常压下,氢气的密度为0.09g/L.
【回答问题】
(1)装置B的作用为除去氯气中混有的氯化氢气体.
(2)根据装置C判断:氯气的密度比空气大(填“大”或“小”)
(3)装置D的作用为Cl
2+2NaOH═NaCl+NaClO+H
2O(用化学方程式表示).
【发现问题】
制备过程中,因盐酸浓度下降导致反应停止.某化学小组同学为测定装置A中反应后残余液中HCl的质量分数,提出两套测定方案如图3所示.
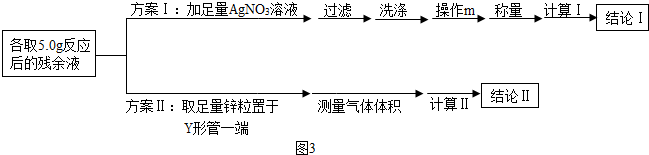
(4)方案Ⅰ中操作m的名称为干燥(或烘干),通过称量生成沉淀的质量,计算出残余液中HCl的质量分数,此测定方案是不可行(填“可行”或“不可行”)的,原因是残余液中的MnCl
2也能与AgNO
3溶液反应生成沉淀,造成测量值偏大;
(5)方案Ⅱ利用图2装置(固定仪器的装置已略)进行测定.
①实验过程中观察到锌粒表面有气泡产生,反应的化学方程式为Zn+2HCl=ZnCl
2+H
2↑;
③当装置恢复至常温时,测得反应生成气体的体积为183.5mL,根据化学方程式计算,残余液中HCl的质量分数为多少?
【反思讨论】
(6)为了保证方案Ⅱ测定结果的准确性,正确操作是:倾斜Y形管,B(填标号)
A.将残余溶液转移到锌粒中 B.将锌粒转移到残余溶液中
(7)Y形管内空气对气体体积的测量没有(填“有”或“没有”)影响.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案