
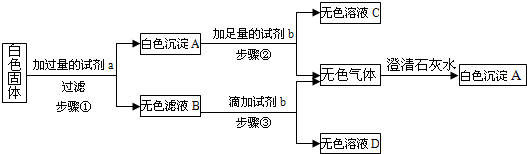
 Na2CO3+CO2↑+H2O.并查阅了相关物质的溶解性如下表:
Na2CO3+CO2↑+H2O.并查阅了相关物质的溶解性如下表:| Cl- | NO3- | CO32- | HCO3- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 溶 | 溶 | 不溶 | 溶 |
| 实验步骤 | 实验现象 | 结论 |
| 实验1:取少量该白色固体于试管中加热,并将产生的气体通入澄清石灰水中. | 澄清石灰水______. | 证明原白色固体中含有碳酸氢钠. |
| 实验2:取实验1中剩余固体于另一支试管中,加入少量稀盐酸并通入澄清石灰水中. | 有气泡产生,澄清石灰水变浑浊. | 证明原白色固体中还含有碳酸钠 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| Cl- | NO3- | CO32- | HCO3- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 溶 | 溶 | 不溶 | 溶 |
| 实验步骤 | 实验现象 | 结论 |
| 实验1:取少量该白色固体于试管中加热,并将产生的气体通入澄清石灰水中. | 澄清石灰水 变浑浊 变浑浊 . |
证明原白色固体中含有碳酸氢钠. |
| 实验2:取实验1中剩余固体于另一支试管中,加入少量稀盐酸并通入澄清石灰水中. | 有气泡产生,澄清石灰水变浑浊. | 证明原白色固体中还含有碳酸钠 |

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤及操作方法 | 预期的实验现象 | 结论 |
| 取少量过氧化钙放入试管中,加足量水,振荡, 静置,取上层清液,通入二氧化碳气体(或滴加酚酞试液) 静置,取上层清液,通入二氧化碳气体(或滴加酚酞试液) . |
清液变浑浊(或变为红色) 清液变浑浊(或变为红色) |
有氢氧化钙产生 |
| 实验的装置 | 实验的主要过程 |
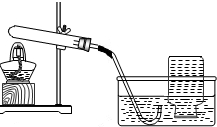 |
a.检查装置的气密性.操作如下:先 将导气管放入水中 将导气管放入水中 ,再用手紧握试管, 观察到 水中出现气泡 水中出现气泡 ,把手松开,导气管口形成一小段水柱;b.向试管中加入CaO2,连接并固定好装置,加热; c.收集一瓶气体.能用图中所示方法收集氧气的原因是 氧气不易溶于水 氧气不易溶于水 ;d.停止加热.停止加热前应先 将导气管从水中取出 将导气管从水中取出 ;e.检验气体.检验的方法是 将带火星的小木条伸入集气瓶中 将带火星的小木条伸入集气瓶中 . |
| 实验的装置 | 实验的主要过程 |
 |
a.检查装置的气密性. b.向试管中加入CaO2和水后,有少量细小气泡缓缓放出,在导气管口几乎收集不到气体.该装置放置到第二天,集气瓶中才收集到极少量的气体,振荡试管后仍然有少量的气泡不断缓缓放出. |
查看答案和解析>>
科目:初中化学 来源:2008年北京市平谷区中考化学一模试卷(解析版) 题型:解答题
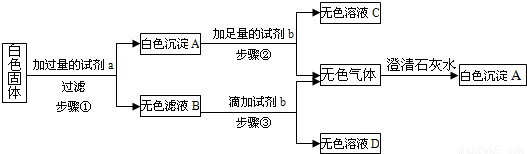
 Na2CO3+CO2↑+H2O.并查阅了相关物质的溶解性如下表:
Na2CO3+CO2↑+H2O.并查阅了相关物质的溶解性如下表:| Cl- | NO3- | CO32- | HCO3- | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 溶 | 溶 | 不溶 | 溶 |
| 实验步骤 | 实验现象 | 结论 |
| 实验1:取少量该白色固体于试管中加热,并将产生的气体通入澄清石灰水中. | 澄清石灰水______. | 证明原白色固体中含有碳酸氢钠. |
| 实验2:取实验1中剩余固体于另一支试管中,加入少量稀盐酸并通入澄清石灰水中. | 有气泡产生,澄清石灰水变浑浊. | 证明原白色固体中还含有碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com