
 汽车制造是盐城市的支柱经济产业之一,汽车制造过程中要用到大量的铁、铜、铝等金属材料,请按要求填空.(1)汽车制造中用得最多的金属材料是钢.钢不是(填“是”或“不是”)纯金属.车体表面喷漆不仅美观,而且可有效防止钢铁与水和氧气接触而生锈.炼铁的原理是利用一氧化碳与氧化铁反应还原出铁,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
汽车制造是盐城市的支柱经济产业之一,汽车制造过程中要用到大量的铁、铜、铝等金属材料,请按要求填空.(1)汽车制造中用得最多的金属材料是钢.钢不是(填“是”或“不是”)纯金属.车体表面喷漆不仅美观,而且可有效防止钢铁与水和氧气接触而生锈.炼铁的原理是利用一氧化碳与氧化铁反应还原出铁,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.分析 (1)根据钢是铁的合金,铁生锈的条件和炼铁的原理分析回答;
(2)根据铜的性质和用途以及质量守恒定律分析回答;
(3)根据铝的性质分析回答;
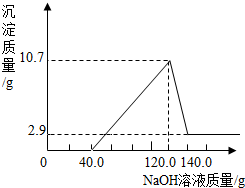
(4)【质疑】根据极值法计算沉淀的质量至少时多少.
①根据生成的氢氧化镁沉淀的质量计算镁的质量,再计算出铝的质量.
②根据溶质质量分数的计算公式计算.
解答 解:(1)汽车制造中用得最多的金属材料是钢.钢不是纯金属,是铁的合金.车体表面喷漆不仅美观,而且可有效防止钢铁与水和氧气接触而生锈.炼铁的原理是利用一氧化碳与氧化铁反应还原出铁,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)汽车电路中的导线大都是铜芯的,这主要是利用了铜的导电性.将赤铜矿(主要成分Cu2O)和辉铜矿(主要成分Cu2S)混合焙烧可得到铜,由反应的方程式及质量守恒定律可知,应填入:SO2↑.
(3)铁、铜、铝三种因素在地壳中的含量多少顺序为Al>Fe>Cu,但三种金属被人类发现和利用的时间是铜最早,而铝最晚,这跟它们的金属活动性有关.铝具有很好的抗腐蚀性能,原因是铝与氧气反应形成了一层致密的氧化铝薄膜.
(4)【质疑】
假设镁的质量是3.9g,生成的氢氧化镁的质量是x
Mg~Mg(OH)2
24~58
3.9g x
$\frac{24}{58}=\frac{3.9g}{x}$ 解得:x=9.425g
假设铝的质量是3.9g,生成的氢氧化铝的质量是y
Al~Al(OH)3
27 78
3.9g y
$\frac{27}{78}=\frac{3.9g}{y}$ 解得:y≈11.27g
按初中化学现有知识计算,沉淀的质量至少为9.425g.
【计算】①设该合金中镁的质量为m
Mg~Mg(OH)2
24 58
m 2.9g
$\frac{24}{58}=\frac{m}{2.9g}$ 解得:m=1.2g
铝的质量为:3.9g-1.2g=2.7g
②设与1.2g镁反应的盐酸中溶质的质量为p
Mg+2HCl═MgCl2+H2↑
24 73
1.2g p
$\frac{24}{73}=\frac{1.2g}{p}$ 解得:p=3.65g
设与2.7g铝反应的盐酸中溶质的质量为q
2Al+6HCl═2AlCl3+3H2↑
54 219
2.7 q
$\frac{54}{219}=\frac{2.7g}{q}$ 解得:q=10.95g
设与氢氧化钠反应的盐酸中溶质的质量为n
HCl+NaOH=NaCl+H2O
36.5 40
n 40g×20.0%
$\frac{36.5}{40}=\frac{n}{40g×20%}$ 解得:n=7.3g
加入的盐酸溶质质量分数为:$\frac{3.65g+10.95g+7.3g}{100g}×100%$=21.9%.
故答为:(1)不是,水和氧气,Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.(2)导电,SO2↑;(3)金属活动性,铝与氧气反应形成了一层致密的氧化铝薄膜.(4)【质疑】9.425g.【计算】①1.2;2.7.②21.9%.
点评 本题主要考查了金属的性质、应用和根据化学方程式的计算,特别是计算的量比较大,应分清各个量之间的关系是解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 石油是可燃物 | |
| B. | 石油是不可再生资源 | |
| C. | 石油不充分燃烧会生成一氧化碳、二氧化硫等有害气体 | |
| D. | 油罐起火,消防队员用高压水枪向油罐喷水,是为了降低石油的着火点 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木炭燃烧后生成黑色固体 | |
| B. | 细铁丝伸入盛有氧气的集气瓶中剧烈燃烧 | |
| C. | 红磷燃烧后生成白烟雾 | |
| D. | 硫燃烧后生成有刺激性气味的气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化学与健康:①食用鲜黄瓜-可大量补钙 ②人体缺铁-易患贫血病 | |
| B. | 化学与生活:①减轻车内异味-开窗通风 ②防止食品受潮-用氧化钙做干燥剂 | |
| C. | 化学与安全:①重金属盐中毒-喝鲜牛奶解毒 ②煤气泄漏-关闭阀门,严禁烟火 | |
| D. | 化学与环境:①使用乙醇汽油-减少空气污染 ②合理使用农药、化肥-减少水污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
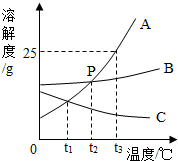 如图是A、B、C三种物质的溶解度曲线,
如图是A、B、C三种物质的溶解度曲线,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com