
| A. | 硫酸铜晶体,胆矾,CuSO4•5H2O | B. | 氯化钠,苏打,NaCl | ||
| C. | 氢氧化钠,纯碱,NaOH | D. | 碳酸钙,生石灰,Ca(OH)2 |
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:初中化学 来源: 题型:实验探究题
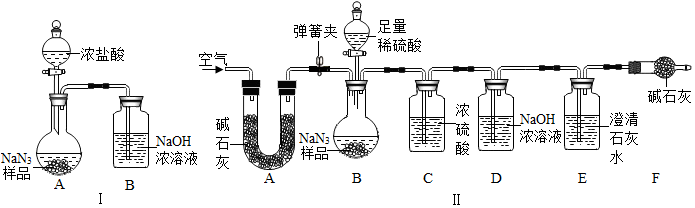
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
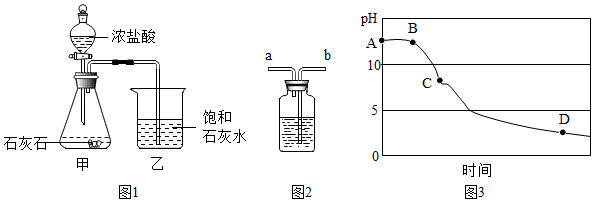
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 实验序号 | 温度(℃) | 大理石颗粒 | 盐酸质量分数(%) | 实验目的 |
| 1 | 20 | 粗 | 5 | 探究大理石和盐酸的反应速度与石灰石颗粒大小的关系 |
| 2 | 20 | 细 | 5 |
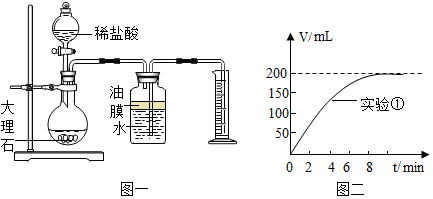
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
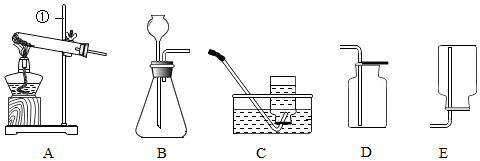
| 实验操作 | 实验现象 | 实验结论 |
| 取少量反应后的废液于试管中,加入足量Na2CO3(填化学式)溶液,振荡. | 大量气泡 | 猜想②正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com