
 在一定条件下,甲、乙、丙、丁在某密闭容器中发生反应,测得反应前后各物质的质量分数如图所示.不正确的说法是( )
在一定条件下,甲、乙、丙、丁在某密闭容器中发生反应,测得反应前后各物质的质量分数如图所示.不正确的说法是( )| A. | 该反应是化合反应 | |
| B. | 若消耗3g乙,则生成17g丙 | |
| C. | 丁可能是该反应的催化剂 | |
| D. | 甲、乙的质量之和一定等于生成丙的质量 |
分析 本题可分析甲~丁四种物质反应前后各物质的质量分数,确定是反应物还是生成物,据此结合题意进行分析判断即可.
解答 解:由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数减少了70%-42%=28%,故甲是反应物;同理可以确定乙的质量分数减少了14%-(1-42%-40%-10%)=6%,故乙是反应物;丙的质量分数增加了40%-(1-70%-14%-10%)=34%,丙是生成物;丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应.
A.该反应的反应物为甲和乙,生成物是丙,符合“多变一”的特征,属于化合反应,丙一定是化合物,故正确;
B.参加反应的乙和生成的丙的质量比为6%:34%=3:17,则若消耗3g的乙,则生成17g的丙,故正确;
C.丁的质量分数不变,可能作该反应的催化剂,也可能没有参加反应,故正确;
D.该反应的反应物为甲和乙,生成物是丙,根据质量守恒定律,参加反应的甲、乙的质量之和(而不是甲、乙的质量之和)一定等于生成丙的质量,故错误.
故选:D.
点评 本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析图中数据,灵活运用质量守恒定律.


科目:初中化学 来源: 题型:选择题
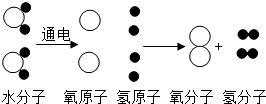
| A. | 在化学反应中原子的数目一定不变 | |
| B. | 在化学反应中元素的化合价一定不变 | |
| C. | 在化学反应中分子的种类一定不变 | |
| D. | 水的质量与生成氢气和氧气的总质量相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石墨烯在一定条件下能氧气反应 | B. | 烯合金是混合物 | ||
| C. | 烯合金具有优良的导电性 | D. | 石墨烯在常温下化学性质活泼 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 霉变的大米蒸熟后食用无害 | B. | 用灼烧的方法能鉴别绦纶和羊毛 | ||
| C. | 用食醋除去水壶中的水垢 | D. | 用加热煮沸的方法降低水的硬度 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
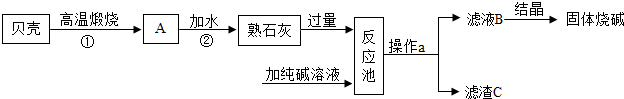
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
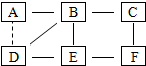 A~F是六种常见物质:铁、氧化钙、盐酸、氢氧化钙、硫酸铜、碳酸氢铵中的某一种,B是胃液中的主要成分,E常用于改良酸性土壤.他们之间的相互关系如图所示(其中实线表示物质间可以相互反应,虚线表示物质间不直接能反应).请回答下列问题:
A~F是六种常见物质:铁、氧化钙、盐酸、氢氧化钙、硫酸铜、碳酸氢铵中的某一种,B是胃液中的主要成分,E常用于改良酸性土壤.他们之间的相互关系如图所示(其中实线表示物质间可以相互反应,虚线表示物质间不直接能反应).请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃,实验时打开导管中的开关.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为40℃,实验时打开导管中的开关.| 内容 步骤 | 【实验1】研究燃烧条件 | 【实验2】研究氧气性质 |
| Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和 烧杯中导管口放置一 小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭,点燃木炭后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2 溶液 | 推入适量H2O2 溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com