
科目:初中化学 来源: 题型:
| 实 验 过 程 | 实验现象 | 实 验 结 论 |
| 向盛有少量NaCl溶液的试管中滴入酚酞试液,振荡 | 溶液无明显 变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
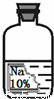
 (2013?如东县模拟)实验室有一瓶保存不当的试剂(如图所示),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小华等几位同学很感兴趣,决定对其成分进行探究.
(2013?如东县模拟)实验室有一瓶保存不当的试剂(如图所示),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小华等几位同学很感兴趣,决定对其成分进行探究.| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 步骤一:取样品于试管中,滴加足量 稀盐酸 稀盐酸 |
产生大量的气泡 | 猜想①正确. 步骤一发生反应的化学方程式是 Na2CO3+2HCl═2NaCl+CO2↑+H2O Na2CO3+2HCl═2NaCl+CO2↑+H2O |
| 步骤二:把产生的气体,通入 澄清石灰水 澄清石灰水 |
石灰水变浑浊 石灰水变浑浊 |
| 探究步骤 | 预计现象 | 结论 |
| 步骤一:取样品于试管中,向其中滴加足量的 CaCl2(或BaCl2等) CaCl2(或BaCl2等) 溶液并过滤 |
产生白色沉淀 | 溶液中: 既含Na2CO3,又含有NaOH |
| 步骤二:向上述滤液中滴加酚酞试液 | 酚酞试液变 红 红 色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实 验 过 程 | 实验现象 | 实 验 结 论 |
| 向盛有少量NaCl溶液的试管中滴入酚酞试液,振荡 | 溶液无明显 变化 | ______ |
查看答案和解析>>
科目:初中化学 来源: 题型:
氢氧化钠是一种重要的化工原料。工业上常用电解饱和食盐水的方法来制取烧碱,并生成氯气(Cl2)和氢气。
(1)请写出工业上用电解饱和食盐水制取烧碱的化学方程式: 。
(2)氢氧化钠溶液中滴入酚酞试液会变红色,氢氧化钠溶液中主要含有Na+、OHˉ、水分子。某探究小组为探究氢氧化钠溶液中的哪种微粒能使酚酞试液变红,设计了如下实验方案,得出了初步结论。
①请填写下表中的实验结论:
| 实 验 过 程 | 实验现象 | 实 验 结 论 |
| 向盛有少量NaCl溶液的试管中滴入酚酞试液,振荡 | 溶液无明显 变化 |
②是否需要做“向水中滴加酚酞试液”的对比实验?为什么?
(3)某化学兴趣小组同学在实验室用氢氧化钠与稀盐酸做探究实验。将两种溶液混合后,对溶液中溶质的可能组成作出如下猜想:
甲同学的猜想是:溶液中只有NaCl。
乙同学的猜想是:溶液中可能含有NaCl、NaOH、和 HCl。
①你认为甲乙两位同学的猜想都合理吗?并说明理由。
②请你提出一个与甲乙同学不同的猜想,并设计简单的实验证明你的猜想成立。
(4)有一瓶因保存不当而部分变质的氢氧化钠固体,为测其成分,称取10g样品配制成溶液,向其中滴加一定质量分数的稀盐酸,充分反应,共放出0.88 g气体,试求样品中氢氧化钠的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源:2013年江苏省南通市如东县中考网上阅卷适应性训练化学试卷(解析版) 题型:填空题
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 步骤一:取样品于试管中,滴加足量 | 产生大量的气泡 | 猜想①正确. 步骤一发生反应的化学方程式是 |
| 步骤二:把产生的气体,通入 |
| 探究步骤 | 预计现象 | 结论 |
| 步骤一:取样品于试管中,向其中滴加足量的 溶液并过滤 | 产生白色沉淀 | 溶液中: 既含Na2CO3,又含有NaOH |
| 步骤二:向上述滤液中滴加酚酞试液 | 酚酞试液变 色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com