
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源:2017届广东省揭阳市揭西县九年级中考模拟化学试卷(解析版) 题型:选择填充题
在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示.下列未知数据计算正确的是( )
物 质 | a | b | c | d |
反应前的质量/g | 20 | 20 | 0 | 0 |
反应一段时间后的质量/g | 12 | 4 | 6 | ① |
反应后的质量/g | ② | 0 | ③ | ④ |
A. ①为22g B. ②为8g C. ③为12g D. ④为22.5g
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
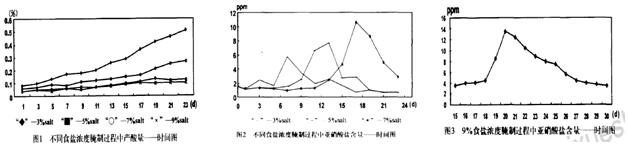
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 由碳、氢、氧三种元素组成 | |
| B. | 氢元素的质量分数最大 | |
| C. | 属于氧化物 | |
| D. | 由6个碳原子、12个氢原子和6个氧原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
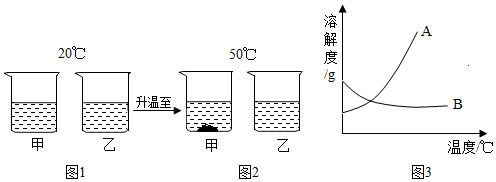
| A. | 图1中甲、乙两种溶液的溶质质量分数一定相等 | |
| B. | 图2中甲溶液一定是饱和溶液,乙溶液也可能是饱和溶液 | |
| C. | 图3中A对应的是甲物质的溶解度曲线 | |
| D. | 50℃时甲、乙两种物质的饱和溶液降温到20℃时,溶质质量分数都减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
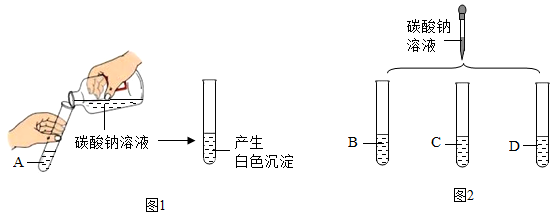 实验室有四瓶失去标签的溶液,现标为A、B、C、D,分别是澄清石灰水、氢氧化钠溶液、稀盐酸、氯化钙溶液中的一种.
实验室有四瓶失去标签的溶液,现标为A、B、C、D,分别是澄清石灰水、氢氧化钠溶液、稀盐酸、氯化钙溶液中的一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com