

| 步骤③的现象 | 步骤⑥、⑦的结果 | 步骤⑧的现象 | 结论 |
| A.______;______ B.带火星的木条复燃. | m2______m1 (填“大于”、小于“或”等于“”) | A.溶液中有气泡放出; B.______. | 猜想ⅠⅡ不成立; 猜想Ⅲ成立. |
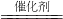 2H2O+O2↑,其中催化剂是Fe2O3.
2H2O+O2↑,其中催化剂是Fe2O3.| 步骤③的现象 | 步骤⑥、⑦的结果 | 步骤⑧的现象 | 结论 |
| A. 有气泡; B.带火星的木条复燃. | m2 等于m1 (填“大于”、小于“或”等于“”) | A.溶液中有气泡放出; B. 带火星的木条复燃. | 猜想ⅠⅡ不成立; 猜想Ⅲ成立. |
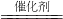 2H2O+O2↑.
2H2O+O2↑.

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
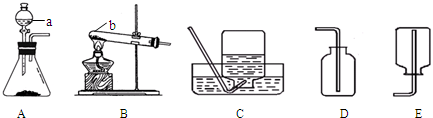
| ||
| ||
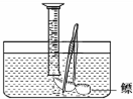
| 方法 | 现象 | 结论 | |
| 验证鳔 内含O2 |
用燃烧的木条检验 用燃烧的木条检验 |
木条能继续燃烧 木条能继续燃烧 |
鳔内含有氧气 鳔内含有氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com