
| A. | 甲醛会破坏蛋白质的结构使其变质,可用来浸泡水产品以防腐 | |
| B. | 氢氧化钠固体能吸水,可用来干燥CO2气体 | |
| C. | 葡萄糖氧化时放出能量,可用来为人体供能 | |
| D. | 氢氧化钠能与酸反应,可用来治疗胃酸过多 |
科目:初中化学 来源: 题型:选择题
 甲、乙两物质的溶解度曲线如图所示,下列说法错误的是( )
甲、乙两物质的溶解度曲线如图所示,下列说法错误的是( )| A. | t1℃时,甲、乙两物质的溶解度相等 | |
| B. | t2℃时甲和乙的饱和溶液溶质质量分数大小关系:乙>甲 | |
| C. | 0~t1℃时,甲的溶解度小于乙的溶解度 | |
| D. | 将甲的饱和溶液变为不饱和溶液,可采用升高温度的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验 | 操作步骤 | 实验现象 | 实验结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石是银白色 | |
| 2 | 取少量打磨后的打火石加试管中,滴加盐酸 | 该金属一定不是铁 | |
| 3 | 取少量打磨后的打火石加试管中,滴加硫酸铜溶液 | 有色物质析出 | 该金属一定是镁 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X Y Z | B. | X Z Y | C. | Y X Z | D. | Z Y X |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | $\underset{Cl}{•}$2、Na$\underset{Cl}{•}$ | B. | $\underset{N}{•}$H4Cl、$\underset{N}{•}$H3 | C. | $\underset{Mn}{•}$O2、K2$\underset{Mn}{•}$O4 | D. | $\underset{Cu}{•}$O、$\underset{Cu}{•}$2O |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
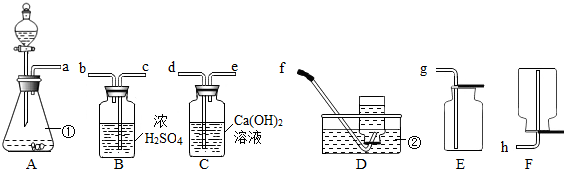
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 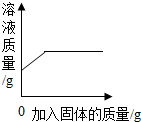 一定温度下,向饱和的硝酸钾溶液中不断加入硝酸钾固体 | |
| B. |  向硫酸和硫酸铜混合溶液中滴加过量的氢氧化钠溶液 | |
| C. |  将等质量的镁粉和铝粉分别与足量等浓度的稀硫酸反应 | |
| D. |  向盛有一定量稀硫酸的烧杯中不断加水稀释 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 反应前/g | 反应后/g | |
| 装置C的质量 | 10.0 | 14.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com