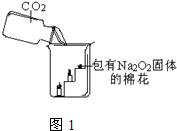
30、过氧化钠(Na
2O
2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na
2O
2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有
密度比空气的大
、
不支持燃烧
的性质.
(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a:
棉花充分与氧气接触
、b:
温度必须达到棉花的着火点
两个条件.
[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:(1)在常温下Na
2O
2能和CO
2发生化学反应.
(2)在常温下Na
2O
2能和水发生反应:2Na
2O
2+2H
2O═4NaOH+O
2↑
(3)无水硫酸铜为白色固体,吸水后变为蓝色.
[设计实验]:经过讨论后,小组同学设计了如图2的实验进行探究.

[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na
2O
2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象.
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响.
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;
③饱和的澄清石灰水变浑浊.
[实验分析]:①检查整套装置的气密性的方法:
先在U型管内装入水,使U型管左右液面保持相平,然后向下推针筒活塞,若U型管左边液面下降,右边液面上升,并稳定一段时间则
说明气密性良好
.
②C装置无水硫酸铜的作用是
证明CO2中的水蒸气确实已被除去
.
③D装置的烧杯内饱和的澄清石灰水的作用是
析出氢氧化钙固体,说明Na2O2和CO2反应放出热量
.
[得出结论]:(1)①“小木条复燃”说明Na
2O
2和CO
2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②
③饱和的澄清石灰水变浑浊
(填装置出现的现象)说明Na
2O
2和CO
2反应使图1中的棉花满足了燃烧的另一个条件.
(2) Na
2O
2和CO
2反应除生成一种气体外,还生成了一种固体,甲认为生成的固体是NaOH,乙认为是Na
2CO
3,同学们经过思考后认为甲同学的猜想是错误的,理由是:
没有水参与反应
.
(3)Na
2O
2和CO
2反应的化学方程式是
2Na2O2+2CO2═2Na2CO3+O2↑
.
[拓展提高]:现有一包保存不当的过氧化钠粉末,已证明其已完全变质.为探究其成分,有同学设计了以下定性和定量两种实验方案,请你帮助完成下列实验报告.
一、定性方案:

二、定量方案:
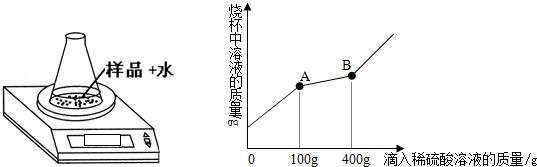
称取39.8g样品于一只质量为45g的锥形瓶中,一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,逐滴滴加溶质质量分数为9.8%的稀硫酸,观察显示数字的变化,并绘制出混合溶液的质量与所滴入稀硫酸溶液的质量关系曲线(如图);请你根据曲线计算出粉末中各成分的质量.



 一线名师权威作业本系列答案
一线名师权威作业本系列答案
 30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.


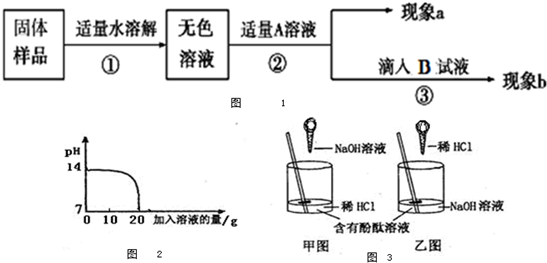


 Na2CO3+CO2↑+H2O;③NaHCO3+HCl═NaCl+CO2↑+H2O;④少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
Na2CO3+CO2↑+H2O;③NaHCO3+HCl═NaCl+CO2↑+H2O;④少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O