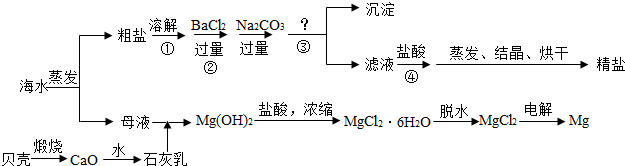
粗食盐中除含有钙、镁、硫酸根等可溶性杂质外,还含有泥砂等不溶性杂质.
实验室中粗食盐提纯的操作如下:
(1)在台称上称取租食盐15克,研细,放入小烧杯中,加40毫升蒸馏水,用电炉加热并搅拌,使其溶解.然后往热溶液中加入3~4毫升25%的BaCl2溶液.小心用电炉保温10分钟,使BaSO4沉淀完全.请问:如何运用最简方法检验溶液中已无SO42-离子?______;
(2)在上述溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止.请问这步操作的目的是______;
(3)将经过操作(2)后的溶液趁热进行减压过滤.请问这一操作能除掉哪些杂质?______;
(4)用纯净氯化氢通入操作(3)所得滤液中,直至不再析出NaCl晶体为止.通氯化氢气体的作用是______;
(5)用减压过滤方法将产品(NaCl晶体)抽干,并将产品移入蒸发皿,在通风橱中炒干.请问烘炒的原因是______.
【答案】分析:(1)加入氯化钡溶液检验溶液中是否有硫酸根离子;
(2)碳酸钠与钙离子、镁离子和过量的钡离子生成沉淀;
(3)过滤可把溶液和不溶于水的物质除去;
(4)通入氯化氢可除去过量的碳酸钠,使氯化钠结晶析出;
(5)氯化氢附着在氯化钠的表面,炒干除去.
解答:解:(1)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴BaCl2溶液,不出现浑浊就说明SO42-已经除尽;
(2)碳酸钠与镁离子生成碳酸镁沉淀、与钙离子生成碳酸钙沉淀、与钡离子生成碳酸钡沉淀,所以滴加饱和碳酸钠溶液,可以除去钙离子、镁离子和过量的钡离子;
(3)过滤可把溶液和不溶于水的物质除去,可以除去硫酸钡、碳酸钙、碳酸镁、碳酸钡和泥沙等不溶性杂质;
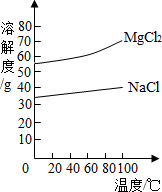
(4)滤液中含有氯化钠和过量的碳酸钠,通入氯化氢,和碳酸钠反应生成氯化钠、二氧化碳和水,可以除去过量的碳酸钠,根据同离子效应,加入氯化氢可以降低氯化钠的溶解度,使氯化钠结晶析出;
(5)氯化钠晶体表面附着氯化氢,可以炒干除去.
故答案为:
(1)静止片刻在上层清液处,滴加一滴BaCl2溶液,不出现浑浊就说明SO42-已经除尽;
(2)除去Ca2+、Mg2+以及加入过量Ba2+;
(3)BaSO4、CaCO3、MgCO3、BaCO3以及泥砂等不溶性杂质;
(4)除去溶液中的CO32-,同离子效应使NaCl结晶析出;
(5)去掉吸附在晶体表面的HCl.
点评:本题考查对粗盐提纯的掌握情况,在解此类题时,首先分析题中的问题,然后结合学过的知识进行分析解答,在除杂质时,注意不能引入新的杂质.



 名校课堂系列答案
名校课堂系列答案