
航天技术中的火箭推进剂可用醇类为燃料,液态氧为氧化剂,但后者的沸点较低(-183℃),需要额外的隔热装置,因而增加了火箭的重量。为了避免此缺点,可用过氧化氢(H2O2)代替液态氧,它具有相对高的沸点和较低的凝固点,而且没有毒性,和醇反应时也能放出很高的能量。现有一液体推进剂以醇(含碳52%,含氢13%,含氧35%)为燃料,质量分数为90%的过氧化氢作氧化剂,欲使1 kg 该醇燃料完全燃烧,计算需消耗质量分数为90%的过氧化氢的质量。(提示:①醇消耗氧的质量可按它的各元素消耗的氧来计算;②H2O2提供的氧可按2H2O2 2H2O + O2↑来计算)
2H2O + O2↑来计算)
科目:初中化学 来源: 题型:
下列说法中正确的是 ( )
A.溶液中可以含有多种溶质
B.析出晶体后的溶液是不饱和溶液
C.用汽油洗去衣服上的油渍是乳化作用的结果
D.增大空气与水的接触面积,可以增大氧气的溶解度
查看答案和解析>>
科目:初中化学 来源: 题型:
某化学小组为测定一瓶失去标签的盐酸的溶质质量分数,分成甲、乙两组,分别用不同的方法进行测定.
实验设计:
甲组:取纯净碳酸钙粉末5g于烧杯中,加入20g该盐酸溶液,充分反应后,过滤、洗涤、干燥,称量得剩余固体3g.
乙组:取纯净碳酸钙粉末5g于锥形瓶中,将20g该盐酸溶液加入分液漏斗,利用测定产生二氧化碳的体积(20℃、标准大气压)计算盐酸浓度.装置示意图如图:
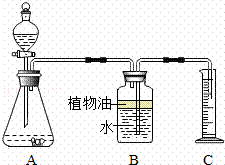
数据处理:
(1)请利用甲组数据计算该盐酸的溶质质量分数.(写出计算过程)
(2)乙组计算结果略小于甲组.经过多次实验仍得到相同结果(忽略量筒引起的误差),可能的原因是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
最近,我国部分城市首次使用二甲醚作为公交车的燃料,有效解决了公交车冒黑烟的问题.二甲醚燃烧的化学方程式可表示为:
C2H6Od(二甲醚)+3O2 2CO2+3H2O
2CO2+3H2O
请通过计算回答:
(1)d= .
(2)23g二甲醚充分燃烧需要多少克氧气?生成多少克二氧化碳?
查看答案和解析>>
科目:初中化学 来源: 题型:
为测定某石灰石样品中碳酸钙的质量分数,取22.2g石灰石样品,放入盛有146 g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质的质量变为159.4g。求:⑴反应生成二氧化碳的质量;⑵石灰石中含碳酸钙的质量分数。
g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质的质量变为159.4g。求:⑴反应生成二氧化碳的质量;⑵石灰石中含碳酸钙的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
在化学反应A+B2=AB2中,A与B2反应的质量关系如图所示,现将8gA和5gB2充分反应,则生成AB2的质量是( )
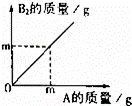
A.10g B. 13g C. 16g D. 18g
查看答案和解析>>
科目:初中化学 来源: 题型:
在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是( )
| 物质 | M | N | Q | P |
| 反应前质量(g) | 18 | 1 | 2 | 32 |
| 反应后质量(g) | X | 26 | 2 | 12 |
A.该变化的基本反应类型是分解反应
B.反应后物质M的质量为13g
C.反应中N、P的质量比为5:4
D.物质Q可能是该反应的催化剂
查看答案和解析>>
科目:初中化学 来源: 题型:
已知A、B为两种黑色粉末,D为红色单质.A、B、C、D、E五种物质之间的转化关系如图所示.请回答:
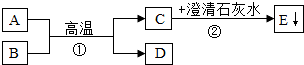
(1)C的化学式为 ;
(2)A中金属元素的化合价是 价;
(3)反应①的化学方程式为 ;
(4)反应②的化学方程式为 .
查看答案和解析>>
科目:初中化学 来源: 题型:
某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:“测定水的组成还有其他的方法吗?”经过讨论后, 得到了肯定的答案,邀请你一起对此展开探究。
得到了肯定的答案,邀请你一起对此展开探究。
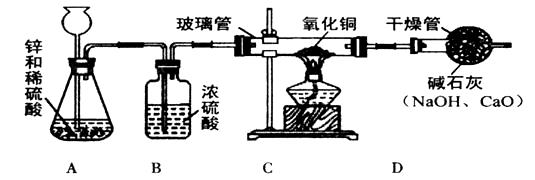
[设计方案]甲同学利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范)。洗气瓶B中浓硫酸的作用为________________________
[实验探究]当玻璃管中固体由黑色转变为红色时,实验测得:
①装置C的玻璃管和其中固体的总质量在反应后减少了1.6g;
②装置D的干燥管和其中物质的总质量在反应后增加了1.82g,用此数据算得水中H、O元素的质量比为________,而由水的化学式算得H、O元素的质量比为________。
[分析交流]针对上述结果与理论值有偏差,乙同学认为:该装置存在缺陷,此观点得到了大家的认同,你对此改进的方法是____________________ (假设生成的水完全被D中碱石灰吸收,装置内空气中的水蒸气、CO2忽略不计)。小组同学用改进后的装置重新实验得到了正确结果。
[意外发现]丙同学不小心将反应后的少量红色固体a洒落到足量稀硫酸中了,发现除了有红色固体b以外,溶液的颜色由无色变为蓝色。
[提出问题]铜与稀硫酸是不反应的,这里溶液的颜色为什么会变蓝呢? 
[查阅资料]
①CuO被还原的过程中会有Cu2O生成,Cu2O也能被还原在Cu;
②Cu2O固体是红色的,它一稀硫酸的反应为:Cu2O+H2SO4=CuSO4+Cu+H2O.
[得出结论]红色固体a中含有Cu2O。
[分析交流]红色固体a中含有Cu2O是否会影响水组成的测定结果________ (填“影响”或“不影响”)。
[提出猜想]针对红色固体a的成分,小组同学提出猜想①是:Cu2O和Cu;猜想②是:________。
[拓展探究]丁同学利用改进后的装置及药品重新实验, 通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体a和玻璃管的总质量,完全反应后,你认为他还需要称量________的质量。
通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体a和玻璃管的总质量,完全反应后,你认为他还需要称量________的质量。
[教师点拨]称取一定质量的红色固体a与足量的稀硫酸充分反应后,经过滤、洗涤、干燥后再称量红色固体b的质量,也可以确定哪种猜想成立。
[定量分析]小组同学再次实验,他们开始称取质量为3.6g的红色固体a,与足量的稀硫酸完全反应后得到红色固体b为2g。假如3.6g红色固体a都是Cu2O,请你计算出生成铜的质量(利用Cu2O+H2SO4=CuSO4+Cu+H2O.进行计算,写出计算过程);然后,通过与实际得到的固体2g进行比较,判断猜想________成立(填①或②)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com