
����Ŀ������ͭ���Ʊ�![]() ϵ��������Ҫԭ�ϣ�ij��ȤС�������չ�������о���
ϵ��������Ҫԭ�ϣ�ij��ȤС�������չ�������о���
![]() ����ͭ���Ʊ��о�
����ͭ���Ʊ��о�
��С��ͬѧ�������Ϸ�����������Ʒ����ɹ�ѡ�ã�
![]() ��ϡ���ᷴӦ��ȡ��
��ϡ���ᷴӦ��ȡ��![]()
![]() ��Ũ���ᷴӦ��ȡ��
��Ũ���ᷴӦ��ȡ��![]()
![]() ͨ������ͭм��ϡ�������ϵ����ȡ��
ͨ������ͭм��ϡ�������ϵ����ȡ��![]()
��ͬѧ��Ϊ���ַ����ķ�Ӧ�����������������н��У���ͬѧ��Ϊ______![]() ��������������������
��������������������![]() ��������
��������![]() ��һ����ѧ����ʽ��ʾ
��һ����ѧ����ʽ��ʾ![]() ______
______![]() �ӻ��������;���Ч��Ƕȿ��ǣ���ȡ����������ͭ���˲������Ϸ���______��������_________��
�ӻ��������;���Ч��Ƕȿ��ǣ���ȡ����������ͭ���˲������Ϸ���______��������_________��
![]() ����ͭ�������о�
����ͭ�������о�
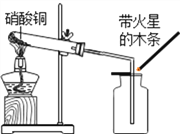
����ͭΪ��ɫ���壬����ˮ�ɵ���ɫ��Һ![]() ��С��ͬѧ����ͼװ�ü�������ͭ�����ֹ�������ɫ��ڣ�ͬʱ��������ɫ�д̼�����ζ�����壬�����ǵ�ľ����ȼ��
��С��ͬѧ����ͼװ�ü�������ͭ�����ֹ�������ɫ��ڣ�ͬʱ��������ɫ�д̼�����ζ�����壬�����ǵ�ľ����ȼ��
��������⡿����ͭ�ڼ��������µ������������ķ�Ӧ��
���������ϡ�
![]() ����ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽ��
����ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽ��![]()
![]() �����������У�ֻ��
�����������У�ֻ��![]() �Ǻ���ɫ���д̼�����ζ�����壮
�Ǻ���ɫ���д̼�����ζ�����壮
![]() ����ȼ�ԣ���ʹ�����ǵ�ľ����ȼ
����ȼ�ԣ���ʹ�����ǵ�ľ����ȼ
��������衿
![]() ���ȷֽ��������______��������������CuO��
���ȷֽ��������______��������������CuO��![]() ��
��
������ʵ�顿
ʵ����� | ʵ������ | ʵ����� |
����I������Ӧ���Թ��еĹ����ˮ����ܽ⣬���ˣ� ______ ������ | ����ȫ���ܽ⣬�õ���ɫ��Һ | ����ͭ�ֽ�����������ͭ�� |
����II������ͼ���Թܺͼ���ƿ֮�����ϴ�ͼ��ʾ��װ�ã����½��м�������ͭ��ʵ�� | ����ƿ������Ϊ��ɫ��______ | ����ͭ�ֽ����������� |
����II��ͬѧ�Dz������µ����Ϻ������ɵ�![]() �������ǹ���
�������ǹ���![]() ______�����������Ϣ��
______�����������Ϣ��
����ý��ۡ�����ʵ������![]() ���ȷֽ�Ļ�ѧ����ʽΪ______��
���ȷֽ�Ļ�ѧ����ʽΪ______��
��С��ͬѧȡ10g������ͭ����һ��ʱ����ʣ����������Ϊ![]() ��������ͭ�ķֽ���Ϊ______��
��������ͭ�ķֽ���Ϊ______��![]() �ֽ���Ϊ�ѷֽ������ͭռԭ����ͭ������������д���������
�ֽ���Ϊ�ѷֽ������ͭռԭ����ͭ������������д���������![]()
����˼�����ۡ�
��֪��ͬ״���£����������ȵ�������Ӹ�����![]() �ݴˣ�ͬѧ����Ϊ����ʹû������
�ݴˣ�ͬѧ����Ϊ����ʹû������![]() ������ʵ����ۺ�����������ͭ������������ʹ�����ǵ�ľ����ȼ����ʵ������Ҳ���Ƴ�
������ʵ����ۺ�����������ͭ������������ʹ�����ǵ�ľ����ȼ����ʵ������Ҳ���Ƴ�![]() ���ܾ�����ȼ��
���ܾ�����ȼ��![]() ������______��
������______��
���𰸡� ������ ![]() ��
�� ![]() ��
��![]() �з�Ӧ����û���ж��������ɣ�����Ⱦ���������������ʸ�
�з�Ӧ����û���ж��������ɣ�����Ⱦ���������������ʸ� ![]() �������м�������ϡ���� �����ǵ�ľ����ȼ �е�
�������м�������ϡ���� �����ǵ�ľ����ȼ �е� ![]()
![]() ����ͭ�ֽ����ɵ�������
����ͭ�ֽ����ɵ�������![]() ��
��![]() �������Ϊ4��
�������Ϊ4��![]() ��ռ����������������
��ռ����������������![]() �����������ͬ���ֽ�����������ʹ������ľ����ȼ���������ܣ�˵��
�����������ͬ���ֽ�����������ʹ������ľ����ȼ���������ܣ�˵��![]() ����ȼ��
����ȼ��
��������![]() ���ַ����ķ�Ӧ�������������������н��У����������Ļ�Ա�ͭǿ����
���ַ����ķ�Ӧ�������������������н��У����������Ļ�Ա�ͭǿ����![]() ���ӻ��������;���Ч��Ƕȿ��ǣ���ȡ����������ͭ���˲��õķ���
���ӻ��������;���Ч��Ƕȿ��ǣ���ȡ����������ͭ���˲��õķ���![]() �����������٢ڲ�����Ⱦ�������к����壻�۷�Ӧ���������ж��������ɣ�����Ⱦ���������������ʸ�����������衿��������ͭ�����ֹ�������ɫ��ڣ�ͬʱ��������ɫ���д̼�����ζ�����壬�����ǵ�ľ����ȼ��˵������������ͭ����ɫ���壩����������ȼ�����壬ʹ�����ǵ�ľ����ȼ��������
�����������٢ڲ�����Ⱦ�������к����壻�۷�Ӧ���������ж��������ɣ�����Ⱦ���������������ʸ�����������衿��������ͭ�����ֹ�������ɫ��ڣ�ͬʱ��������ɫ���д̼�����ζ�����壬�����ǵ�ľ����ȼ��˵������������ͭ����ɫ���壩����������ȼ�����壬ʹ�����ǵ�ľ����ȼ��������![]() ������ɫ���壩��������ʵ�顿��Ϊ����ͭ������ˮ������ͨ���ܽ⣬���ˣ�ϴ�ӵķ�ʽ����������ʽ��з��롣�������ϡ���ᣬϡ����������ͭ��Ӧ��������ͭ���õ���ɫ��Һ��NO2������Һ����ͨ������������ܽ���Һ�����Ӷ�������������룬ʣ��������Կ���ʹ������ľ����ȼ��˵��Cu��NO3��2���ȷֽ����������������ý��ۡ�����ʵ������
������ɫ���壩��������ʵ�顿��Ϊ����ͭ������ˮ������ͨ���ܽ⣬���ˣ�ϴ�ӵķ�ʽ����������ʽ��з��롣�������ϡ���ᣬϡ����������ͭ��Ӧ��������ͭ���õ���ɫ��Һ��NO2������Һ����ͨ������������ܽ���Һ�����Ӷ�������������룬ʣ��������Կ���ʹ������ľ����ȼ��˵��Cu��NO3��2���ȷֽ����������������ý��ۡ�����ʵ������![]() ���ȷֽ�Ļ�ѧ����ʽΪ
���ȷֽ�Ļ�ѧ����ʽΪ![]() ���跴Ӧ������ͭ������Ϊx
���跴Ӧ������ͭ������Ϊx
2Cu��NO3��2 ![]() 2CuO + 4NO2��+O2�����������
2CuO + 4NO2��+O2�����������
376������������ 160�������������� ��216
X���������������������������� 10g��4.6g
376/x=216/��10g��4.6g��![]()
X=9.2g��������
������ͭ�ķֽ���Ϊ��9.2g��10g��100%=92%
����˼�����ۡ�ͨ����ѧ��Ӧ������ͭ�ֽ����ɵ�������NO2��O2�������Ϊ4��1��O2��ռ����������������O2�����������ͬ���ֽ�����������ʹ������ľ����ȼ���������ܣ�˵��NO2����ȼ�ԡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������(��ѧʽΪKClO3)�ʹ����������̵Ļ������Ʊ�������ͬʱ�����Ȼ��أ��÷�Ӧ�Ļ�ѧ����ʽΪ________����ʵ���з����д̼�����ζ�����������
��������⡿�̼�����ζ��������ʲô��?
��������衿����һ������(��ѧʽΪO3) �������HCl ��������Cl2
ͬѧ����Ϊ����ʵ����֤�Ϳ����жϲ���________�Ǵ���ģ�����Ϊ________��
���������ϡ�
(1)C12+H20===HC10+HCl�� AgNO3 +HCl===AgCl�� + HNO3��
(2)������MnO2���ڵ�����¼��ֽ��������
(3)������ʹʪ��ĵ��۵⻯����ֽ������
��ʵ��̽����
�������Ϻ�����Ϊ����һ�Ǵ���ģ�����Ϊ________��
���ǽ�һ������������ʵ�飺ȡ����غͶ������̵Ļ��������Թ��м��ȣ���պ����������Һ�IJ����������Թܿ�(����ͼ)��������������________���ٽ�ʪ��ĵ��۵⻯����ֽ�����Թܿڣ���ֽ��________ɫ������֤����������ȷ��
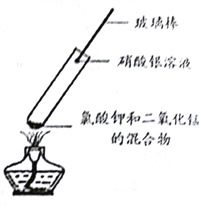
����˼��չ��
(1)��֤����������������طֽ�Ĵ�������֤���������̵�________�ڷ�Ӧǰ�䡣
(2)����ˮ������������ɱ��������������ˮ��Ӧ������H+��Cl����ClO������Ұ�ⳣ��Ư��[��Ҫ�ɷֻ�ѧʽΪCa(ClO)2]������Ϊ��ˮ����ɱ���������õ�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ��Һ�к���AgNO3��Zn(NO3)2��Fe(NO3)2����Ҫ�����������õ�����ƷFeSO4��7H2O����������������

(1)����1���ò��������У��ձ�����������_______������3����������Ũ����________�����ˡ�ϴ�ӡ�����ȡ�
(2)ȷ�Ϲ���Ag��ϴ�ɾ��IJ����ǣ������һ��ϴ�Ӻ����Һ�е���______��Һ��������
(3)�������й�˵����ȷ����___________��
a������X��п b������2������3������������ͬ c����ҺB�е�������2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ҩ�е����Ƚⶾҩ�����кڽ���߰![]() ��ѧʽ
��ѧʽ![]() ��H7N9�������ܹ��ܺõ�Ԥ�����á����жԺڽ���߰��˵����ȷ����
��H7N9�������ܹ��ܺõ�Ԥ�����á����жԺڽ���߰��˵����ȷ����![]()
A. �ڽ���߰��������Ԫ����ɵĻ�����
B. �ڽ���߰����39��ԭ��
C. �ڽ���߰��C��H��N��O��SԪ�ص�������Ϊ10��17��1��9��2
D. �ڽ���߰����Է�������Ϊ359
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������й㷺���ڡ���Ԫ�ص������Ϣ��ͼ��ʾ����ش��������⣺
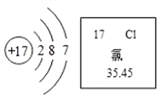
![]() ��Ԫ��λ�ڵ�______���ڡ�
��Ԫ��λ�ڵ�______���ڡ�
![]() ��ԭ�ӵ�����������Ϊ______���õ�______�����ӣ�ת����______
��ԭ�ӵ�����������Ϊ______���õ�______�����ӣ�ת����______![]() �����ӷ��ű�ʾ
�����ӷ��ű�ʾ![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ʹ����㷺��һ�ֽ���������ʯұ��������һ�����ӵĹ��̡���ͼΪ��¯������ʾ��ͼ��
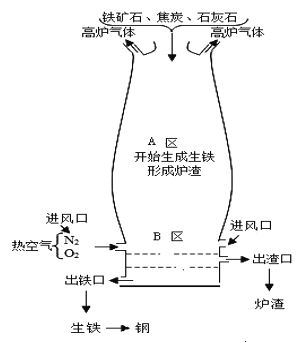
(1)����ͼʾд����A�����������Ļ�ѧ��Ӧ����ʽ____________��
(2)���ۡ�����̿����ʯ�����κ�ˮ�Ȱ�һ���ı������Ƴ�ů������ů�����ܹ����ȣ���Ҫ��ϸ���۵Ĺ��ͣ������������ԭ�����ڹ���������ʵ�����ɻ�ѧ��ת��Ϊ_____________�ܡ�
(3)�����������ɸ֡����������������Ľ������ܣ��Ƴɵ������������ã���˲���ֲ;߹㷺�����ͥ�������ǹ��ڲ���ֲ;�ʹ�õ�һЩ�۵㣬����ͬ����____________��
a������ֲ;Ȳ�������ʹ�÷���
b������ֲ;߲���������ϸ������ʢ���Ȳ˻�����
c������ֲ;߿ɳ�ʱ��ʢ���Ρ����͡��ס�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������������(��Ҫ�ɷ���Fe3O4�� Fe2O3)��ú����ԭ���Ʊ�FeCO3����Ҫ����������
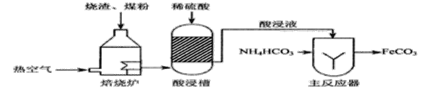
(1)�������õķ���̬����ϡ�����������ʱ�������������ȼ�����壬���ɸ�����Ļ�ѧ����ʽΪ_________________��
(2)����Ӧ���У���Һ�¶ȿ�����35�����µ���Ҫԭ����__________��
(3)ҽ������̼������(FeCO3)������ʳ�ã������ڷ���_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����ڱ��еIJ�����Ϣ�����Ľṹʾ��ͼ����ش��������⡣

(1)̼ԭ�ӵĺ��������_______��
(2)��ԭ�ӵ�������Ϊ_____________��
(3)�ڻ�ѧ��Ӧ��������ʧȥ���ӵ���_____________(����)��
(4)��D ��E���������������ӵ���______________(�����ӷ���)��
(5)д��A��B��D����Ԫ����ɵĻ�����Ļ�ѧʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС����̽������Ļ�ѧ���ʣ���������ʵ�飺
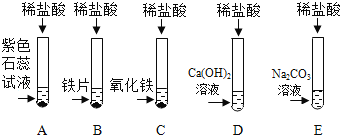
(1)�Թ�A�е�������________����Ӧ���Թ�B��һ���е���������______(д���ӷ���)��
(2)�Թ�C�з�Ӧ�Ļ�ѧ����ʽΪ___________��
(3)ʵ�������С��ͬѧ��D��E��֧�Թ��еķ�Һͬʱ����һ���ྻ���ձ��У��۲쵽�������ݲ��������а�ɫ�������ɡ�ͬѧ�ǽ��ձ��ڵ����ʽ��й��ˣ���������Һ�����ʳɷֽ���̽����
��������롿
��ͬѧ���룺NaCl�� ��ͬѧ���룺NaCl��CaCl2����ͬѧ���룺NaCl��CaCl2��HCl��
��ͬѧ�IJ��룺NaCl��Na2CO3��
���������ϡ�NaCl��CaCl2��Һ��������
���������ۡ���ͬѧ��Ϊ��ͬѧ�IJ���һ������ȷ��������____________��
�����ʵ�顿�ҡ�����λͬѧ�ֱ��������ʵ����֤�Լ��IJ��룺
ʵ�鷽�� | ʵ�鲽�� | ʵ������ | ʵ����� |
�� | ȡ������Һ���Թ��У������еμ���ɫ��̪��Һ | ���������� | ������ȷ |
�� | ȡ������Һ���Թ��У������еμ�ϡ���� | ______ | ������ȷ |
����˼���ۡ�ʵ�������ͬѧ��Ϊ_____(����������������)ͬѧ��ʵ����۴���ԭ����_____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com