


分析 (1)根据实验室制取氧气的反应物有过氧化氢溶液和二氧化锰,加热氯酸钾和二氧化锰,加热高锰酸钾,所以加热某固体纯净物制取氧气的高锰酸钾,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,该反应的反应物是固体,反应条件是加热进行分析;
(2)根据有孔隔板可以利用气压的作用将固体和液体分离,达到反应停止的目的,氢气和氧气在点燃的条件下生成水进行分析;
(3)根据氨气密度比空气小,极易溶于水进行分析.
解答 解:(1)实验室制取氧气的反应物有过氧化氢溶液和二氧化锰,加热氯酸钾和二氧化锰,加热高锰酸钾,所以加热某固体纯净物制取氧气的高锰酸钾,高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,该反应的反应物是固体,反应条件是加热,加热高锰酸钾需要在试管口放一团棉花,所以应选择的发生装置为:B;
(2)有孔隔板可以利用气压的作用将固体和液体分离,达到反应停止的目的,所以E装置具有的突出优点是:便于控制反应的发生和停止,氢气和氧气在点燃的条件下生成水,化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
(3)氨气密度比空气小,极易溶于水,所以用右图所示装置来收集氨气,氨气应该从b端进入,为防止氨气污染空气,G装置与水的接触面积大,不会造成倒吸,最好选用F、G其中的G装置来吸收尾气.
故答案为:(1)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,B;
(2)便于控制反应的发生和停止,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
(3)b,G.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
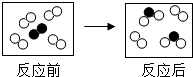 如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )
如图所示是某反应前后的微观示意图,“○”和“●”表示两种不同的原子.下列说法正确的是( )| A. | 有单质生成 | B. | 是化合反应 | ||
| C. | 参加反应的两种分子个数比为4:1 | D. | 反应前后元素的化合价没有变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
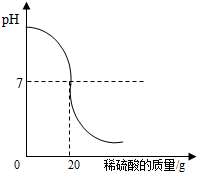 为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液50g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如图所示.计算:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.
为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液50g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如图所示.计算:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 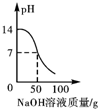 | B. | 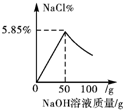 | C. | 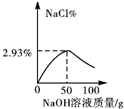 | D. | 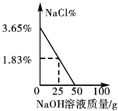 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
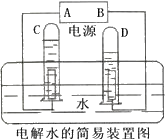 如图是电解水的简易装置.
如图是电解水的简易装置.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,滴加适量的盐酸 | 有气体产生,气体使石灰水变浑浊 | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液 | 品红褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com