
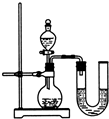
 如图所示,进行中和反应实验:
如图所示,进行中和反应实验: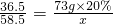
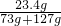 ×100%=11.7%
×100%=11.7%

科目:初中化学 来源: 题型:

| 加入盐酸的体积(V)mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升 (△t)℃ | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 | 12.9 |

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 21、化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
21、化学调研小组的同学用氢氧化钠和稀盐酸探究中和反应,请你参与以下探究:
查看答案和解析>>
科目:初中化学 来源: 题型:
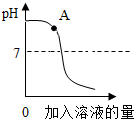 (2013?松江区二模)用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:
(2013?松江区二模)用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.
物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验.| 编号 | 盐酸 | NaOH溶液 | △t℃ |
| 1 | 3.65% | 2.00% | 3.5 |
| 2 | 3.65% | 4.00% | |
| 3 | 7.30% | 8.00% | 14 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 已知甲、乙分别是稀硫酸和氢氧化钠溶液中的一种.某化学兴趣小组的同学在探究甲和乙溶液进行中和反应时,测得反应过程中溶液酸碱度变化及相关数据如图所示.试根据要求,回答下列问题:
已知甲、乙分别是稀硫酸和氢氧化钠溶液中的一种.某化学兴趣小组的同学在探究甲和乙溶液进行中和反应时,测得反应过程中溶液酸碱度变化及相关数据如图所示.试根据要求,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com