

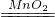 2H2O+O2↑
2H2O+O2↑
 ×100%=4.25%
×100%=4.25%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
| 学生 | 选用试剂 | 评价(是否可行,并简述理由) |
| 甲 | HCl | |
| 乙 | H2SO4 | |
| 丙 | Ba(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| △ |
| ||
| △ |
| 猜想 | 主要操作 | 主要现象 | 实验结论 |
| 猜想一 | 打磨R丝,并将其插入到硫酸铜溶液中 | R丝表面覆盖了一层红色的物质 | 猜想一 不成立 不成立 (填“成立”或“不成立”) |
| 猜想二 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中 | ①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色 ②铝丝表面产生气泡较快 ③铜丝表面没有气泡产生 |
猜想二成立. R与稀硫酸反应的化学方程式为 R+H2SO4═RSO4+H2↑ R+H2SO4═RSO4+H2↑ |
| 猜想三 | 将打磨过的铝丝插入到RSO4[或RCl2或R(NO3)2]溶液中 将打磨过的铝丝插入到RSO4[或RCl2或R(NO3)2]溶液中 |
无明显现象 | 猜想三成立 |
查看答案和解析>>
科目:初中化学 来源:2010年江苏省泰州市高港实验学校中考化学模拟试卷(解析版) 题型:填空题
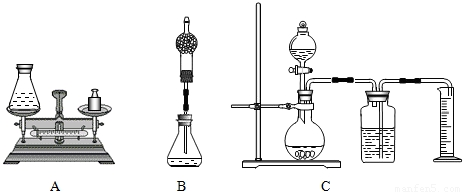
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com