
����Ŀ������֮�������ϵ���ҳ���ϵ�����ֹ���������ѧ�û�ѧ��һ�ֻ���������
(1)�ṹ�������ʣ��о����ֺ�����������(��O��O��)�������ʾ��к�ǿ�������ԣ�������ɱ�����������ݴ��Ʋ⣬���������У�������ɱ������������____________(���������)��
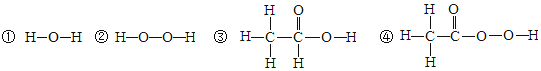
(2)�˵����Ϊ1��18��Ԫ�ص�ԭ�ӽṹʾ��ͼ����Ϣ��ͼ���ش��������⣺
�ڵ�3�����У���ԭ�Ӻ�������Ų��ı仯������__________________��
(3)�ϱ�������(Be)Ԫ�ػ�ѧ�������Ƶ�Ԫ��Ϊ(��Ԫ������)____________��
(4)һ���˵�����Ӳ�����ͬ��ԭ��(ϡ���������)��ԭ�ӵİ뾶��ԭ�������ĵ�������С��������������ͬ��ԭ�ӣ�ԭ�ӵİ뾶����Ӳ��������Ӷ�������Ƚϣ�
��ԭ�Ӱ뾶____(��������������������ͬ)��ԭ�Ӱ뾶����ԭ�Ӱ뾶____��ԭ�Ӱ뾶��
(5)�о���������ͬһ�����У������ң�ԭ��ʧȥ���ӵ������������õ����ӵ���������ǿ���ɴ��ƶϣ����������еõ���������ǿ����_________ԭ�ӣ�ʧ����������ǿ����______ԭ�ӣ���������ȶ��ṹ����______ԭ�ӡ�
���𰸡� �ڢ� ������������1������8 þ �� �� �� �� �
����������1������������������С�����������-O-O-���������Ǣڢܣ����к�ǿ�������ԣ�������������
��2���ڵ��������У���ԭ�ӽṹ�Ĺ�֮ͬ����ԭ�Ӻ�����Ӳ�����ͬ���������У������ң���ԭ�Ӻ�������Ų��ı仯�����������������������ӣ�
��3��Ԫ�صĻ�ѧ����ȡ������������������(Be)��þ��Mg��Ԫ��ԭ��������������Ϊ2����������(Be)Ԫ�ػ�ѧ�������Ƶ�Ԫ��Ϊþ��
��4��ͬһ�����У�ԭ�ӵİ뾶��ԭ�������ĵ�������С��������������ͬ��ԭ�ӣ�ԭ�ӵİ뾶����Ӳ��������Ӷ�����������ԭ�Ӱ뾶����ԭ�Ӱ뾶����ԭ�Ӱ뾶����ԭ�Ӱ뾶��
��7���о���������ͬһ�����У������ң�ԭ��ʧȥ���ӵ������������õ����ӵ���������ǿ���ɴ��ƶϣ����������еõ���������ǿ������ԭ�ӣ�ʧ����������ǿ������ԭ������������ȶ��ṹ�����ԭ�ӡ�


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij��Ӧ����ʾ��ͼ������˵������ȷ����
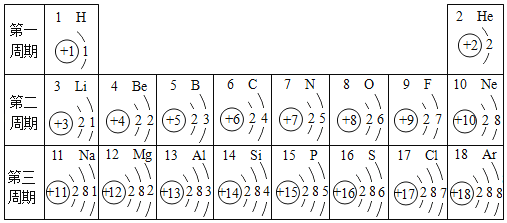
A. ��Ӧ����������������������е���
B. �μӷ�Ӧ�ķ�Ӧ��ķ��Ӹ�����Ϊ1��1
C. ��Ӧǰ��Ԫ�صĻ��ϼ�û�з����仯
D. ��Ӧǰ��ԭ�ӵ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���ʵ��Ļ�ѧ������գ�
��2����ԭ��______���� 3�����������______��
�� ���ֶ�����̼��ѧ���ʵ���С��______��
������þ��þԪ����������______�� �������к�����������_______��
������ȱ__________Ԫ�ػ��٪��֢��
(2)���������ʵ���ĸ�����գ�
A��þ B������ C������ D������ E���ӵ�ʳ��
�ٿ����ڼ��Ȳ��˵���_________��
�ڿ���������������_________��
�ۿ����к�����������_______��
�ܾ�ˮʱ��ʹˮ��С�������������________��
�ݿ��ó�����ζƷ����_______��
(3)д�����з�Ӧ�Ļ�ѧ����ʽ��
�ٺ���ȼ��_________ �ڼ�������غͶ������̻����_______
��̼�����ȷֽ�_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ȡ�����ԭ��ѡ����ȷ���ǣ� ��
A���ô���ʯ��ϡ������ȡ������̼
B���ü��ȸ��������ȡ����
C����ϡ�����ͭ�۷�Ӧ��ȡ����
D����˫��ˮ���ֽ���ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼʵ��װ�ý��лش�
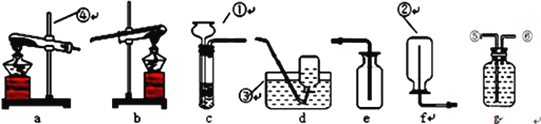
(1)��������������
��_________�� ��________��
(2)��Ҫ��ȡ���ռ�һƿ��������������˿�������е�ȼ�����飬����_________��_______���ס�(��a��f��ѡ��)
(3)e��f�еĵ��ܾ�Ӧ�ӽ������ڵײ�����Ϊ�˽�ƿ�еĿ���_________��
(4)����gװ��װ��ˮ�������ռ���������Ӧ��____ (����������������)�뷢��װ��������
(5)ʵ�����������������壬���ü�����ˮ���������ʯ�ҵĹ��������Ƶã��Ƽ�������ķ���װ��Ӧѡ��_____(����ĸ)װ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д�����з�Ӧ�����ֱ���ʽ��(����һ��)
(1)��ˮ�μӵķֽⷴӦ_____________________________________��
(2)�д̼�����ζ���������ɵĻ��Ϸ�Ӧ��_______________________
(3)���Ȱ���ɫ�����Ʊ�һ������____________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E����Ԫ�أ�AԪ����ɵĵ�����һ�������Դ��BԪ�ش�2������ɵ������Ӻ�����Ӳ�ṹ��Neԭ����ͬ��CԪ�ص�ij������������ΪCO3������CԪ������Ԫ�ص�������Ϊ2:3��DԪ�ص�ԭ�����������Ӳ㣬���ڲ���������2����EԪ���ǵؿ��к����ڶ���Ľ���Ԫ�ء���ش��������⣺
(1)�������ķ�չ����Դ�ͻ��������Ϊ����һ���ȵ㻰�⣬�������ѧ��֪ʶ�ҵ�һ���ܲ���A���ʵķ���(�û�ѧ���ű�ʾ)��____________________________��
(2)д��A��B�����γɵĻ�����Ļ�ѧʽ_______��________.
(3)д��B��C��D����Ԫ���γɵĻ�����Ļ�ѧʽ��____________.
(4)д��ʵ�����ð�ɫ����ͺ�ɫ��ĩ��ȡ����B�ķ�Ӧԭ��(���ű���ʽ)��___________.
(5)EԪ���γɵĵ�������BԪ���γɵĵ�����һ�������¾��ҷ�Ӧ����д���÷�Ӧ�ķ��ű���ʽʽ��___________________________���÷�Ӧ������Ӧ����Ϊ��_______________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У�ֻ���������仯���� �������������������������������������� ��
A. ����ȼ�� B. ����ù�� C. �������� D. ��ҩ��ը
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������벻��ˮ����ͼ������ˮ����ˮ����ʾ��ͼ��
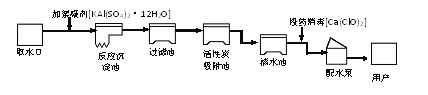
�����ʾ��ͼ�ش��������⣺
(1)����ˮ����������ˮʱ������ʹ�õľ�ˮ������___________��(д��ĸ)
A������ B������ C������ D������
(2)Ϊ�˾���ˮ����������������������������������__________________ ��
(3)ʹ��Ӳˮ���������������������鷳������_______ ������ˮ��Ӳˮ��������ͨ����____________ ������ˮ��Ӳ�ȡ�
(4)������ˮ����ˮ�����У�������ѧ�仯�Ļ�����_________________��
(5)ÿһ��ˮ����֮���ף��о�һ�������о�����еĽ�ˮ��ʩ_____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com