(2011?杨浦区二模)请参与某化学学习小组进行研究性学习的过程,并协助完成相关任务:
(1)为了验证铜、银、镁、铁的金属活动性顺序,小明同学设计如下实验方案:
a.将金属镁和铁分别放入到稀酸溶液中;b.将铜片放入到硝酸银溶液中.
①在步骤a中,所控制的实验条件是
金属的形状和酸的种类、浓度
金属的形状和酸的种类、浓度
.
②小红同学认为,小明同学的实验方案不足以说明铜、银、镁、铁的金属活动性顺序,还需要进行一个实验,该实验的实验步骤是
铜放入稀酸中
铜放入稀酸中
.
(2)小王同学选择“镁丝和硫酸反应的快慢与什么因素有关”的课题开展探究.下表是他分别用相同质量的镁丝和足量稀硫酸反应的三组实验数据:
| 实验编号 |
硫酸的质量分数/% |
反应的温度 |
镁丝消失的时间/s |
| ① |
3 |
20 |
500 |
| ② |
6 |
20 |
300 |
| ③ |
6 |
30 |
80 |
①实验②和③表明:该反应快慢与
温度
温度
有关.
②能表明硫酸浓度对反应快慢有影响的实验编号是:
①
①
和
②
②
.
③如果实验①中硫酸的质量分数改为4%,请推出镁丝消失的时间(用t表示)的取值范围
300<t<500
300<t<500
.
④该实验除了用镁丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量反应的快慢吗?方法
收集等量氢气所需时间
收集等量氢气所需时间
.



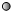 ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,则如图所示的化学反应方程式为:
”表示氧原子,则如图所示的化学反应方程式为: